��Ŀ����
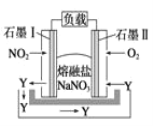
����Ŀ����������Ҫ���� Ag2S��������ͭ��п������Ǧ���������ҵ��������������ȡ�������������ͼ����ͼ��ʾ����֪�� �Ȼ������� �ܰ�����ת��Ϊ�Ȼ����ش��������⣺

��1���� �Ȼ������� ���¶ȿ����� 650��670�棬����¶ȹ�����Ա��ղ��������ʻή�ͣ�ԭ���� ______��
��2��ˮϴ�����Һ�������������κʹ������Σ�ȡ������Һ���������ữ���ٵ����Ȼ�����Һ�а�ɫ�������ɣ�������Ϊ_____���ѧʽ����
��3������ʱ�����Ļ�ѧ��Ӧ����ʽΪ________��
��4���� ������ ���� N2H4��ԭ���Ļ����
��N2H4�ĵ���ʽ��_______��
�������ϣ�1molN2H4��ȫ��Ӧ���õ��Ĺ���������______g��
��������ĸҺ�м����ռ�õ����������ʿɷֱ�________ ��______������ѭ��ʹ�á�
��5�����ۼ� Na2CO3�� Na2B4O7���������ã�һ�ǽ����������۵㣬�����ܺģ�����____������________�ķ������Խ�һ��ֱ�Ӿ���������
���𰸡��¶ȹ��ߣ��Ȼ�������̳����ݣ����²��ʽ��ͣ����¶ȹ��ߣ��ᷢ����������Ӧ�����²��ʽ��ͣ� Na2SO4 AgCl + 2NH3��H2O = Ag��NH3��2Cl + 2H2O ![]() 432 ���� �Ȼ����� ʹ�������ʹ�����븡������������Ĵ��� ���
432 ���� �Ȼ����� ʹ�������ʹ�����븡������������Ĵ��� ���
��������
��֪����ͼ�е����Ȼ��������ܰ�����ת��Ϊ�Ȼ����������O2��NaCl���Ȼ�������������SO2��AgCl���ټ�ˮϴȥ���������Σ��õ�������AgCl������NH3��H2O������ӦAgCl + 2NH3��H2O = Ag(NH3)2Cl + 2H2O��������N2H4���л�ԭ���õ�NH4Cl��NH3��Ag���ʣ���Ӧ����ʽΪ4Ag(NH3)2Cl+N2H4===4Ag+N2+4NH4Cl+4NH3������پ���������õ��������ݴ˷���������⡣
(1)���Ȼ������������У����¶ȹ��ߣ��Ȼ��������̳����ݣ����ᷢ����������Ӧ�����²��ʽ��ͣ��ʴ�Ϊ���¶ȹ��ߣ��Ȼ�������̳����ݣ����²��ʽ��ͣ����¶ȹ��ߣ��ᷢ����������Ӧ�����²��ʽ��ͣ���
(2)��Һ�������������κʹ������Σ�ȡ������Һ���������ữ���ٵ����Ȼ�����Һ�а�ɫ�������ɣ�˵������SO42-��������εĻ�ѧʽ��Na2SO4���ʴ�Ϊ��Na2SO4��
(3)��������������֪������ʱ�����Ļ�ѧ��ӦΪAgCl + 2NH3��H2O = Ag��NH3��2Cl + 2H2O���ʴ�Ϊ��AgCl + 2NH3��H2O = Ag(NH3)2Cl + 2H2O��
(4)��N2H4�ǹ��ۻ���������ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�ڳ��������з�����Ӧ4Ag(NH3)2Cl+N2H4===4Ag+N2+4NH4Cl+4NH3����������1molN2H4��ȫ��Ӧ���õ�4molAg��������Ϊ4mol��108g/mol=432g���ʴ�Ϊ��432��
������ĸҺΪNH4Cl�������м����ռ�ɷ�Ӧ�õ�NaCl��NH3��H2O���ɷ������Ȼ�����������������������ѭ��ʹ�ã��ʴ�Ϊ���Ȼ����գ�������
(5)���ۼ�Na2CO3�� Na2B4O7�ȿ��Խ����������۵㣬�����ܺģ��ֿ���ʹ�������ʹ�����븡������������Ĵ��ȣ��������������������������������������������Һ���ɵ��أ���һ�����������������õ��ķ�����һ��ֱ�Ӿ����������ʴ�Ϊ��ʹ�������ʹ�����븡������������Ĵ��ȣ���⡣

����Ŀ������ˮ�ܿ�(��Ҫ�ɷ�ΪCo2O3��������Fe2O3��Al2O3��MnO��MgO��CaO��SiO2��)������ȡ���ֻ����Լ�����ͼ�Dz����ܾ�����Ȼ��ܾ�����Ʊ����̣��ش��������⣺
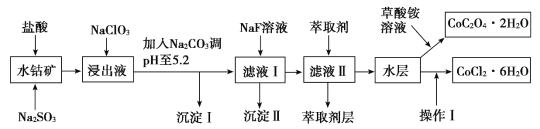
��֪���ٽ���Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+��Mg2+��Ca2+�ȡ�
�������в���������������������ʽ����ʱ��Һ��pH������
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1������������Co2O3������Ӧ�����ӷ���ʽΪ______________��
��2��1molNaClO3�ڽ���Һ�з�����Ӧʱ��ת�Ƶĵ�����Ϊ_________��
��3������Na2CO3��pH��5.2ֻ�õ����ֳ����������I�ijɷ�Ϊ______________���ѧʽ����ͬ������ȡ���㺬��Ԫ�أ������������Ҫ�ɷ�Ϊ______________��
��4����������������ˮ�����Ũ�������pHΪ2��3��________��________�����ˡ�ϴ�ӡ���ѹ��ɵȹ��̡�
��5����5.49g�����ܾ���(CoC2O4��2H2O)�������������ȣ����ȹ����У���ͬ�¶ȷ�Χ�ڵõ�һ�ֲ�ͬ�Ĺ������ʣ������������
�¶ȷ�Χ/�� | ��������/g |
150��210 | 4.41 |
290��320 | 2.41 |
���ⶨ���������ȹ��̲���������ֻ��ˮ������CO2����290��320����Χ�ڣ�ʣ��������ʵĻ�ѧʽΪ______________��