��Ŀ����
����Ŀ��CO2�Ļ����������ǿ�ѧ���о����ȵ���⣬������CH4��CO2�Ʊ����ϳ�����(CO��H2)�������Ʊ��״��������ѡ���̼ϩ����ȼ�ϲ�Ʒ��
I.�ƺϳ���
��ѧ������Ʊ������ϳ�������Ӧ���̷�������
��Ӧ��: CH4(g)C(ads)+2H2(g) (����Ӧ)
��Ӧ��:C(ads)+CO2(g)2CO(g) (�췴Ӧ)
������Ӧ��C(ads)Ϊ�����Ի���̿����Ӧ���̵������仯����ͼ��

(1) CH4��CO2�Ʊ����ϳ��������Ȼ�ѧ����ʽΪ____�� �����仯ͼ�У�E5+E1_______E4+ E2(����>�� �� ��< �� �� ��= ��)��
II.�״��ϳ�
��ij CO �������Ƽ״��ķ�Ӧ��ϵ�У���������Ҫ��Ӧ�У�
i. CO2(g) + 3 H2(g)CH3OH(g)+H2O(g)��H1< 0
ii.CO2(g) + H2(g)CO (g)+H2O(g) ��H2>0
iii . CO(g)+2H2( g)CH3OH(g) (g) ��H3< 0
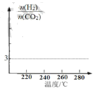
(2)5MPa ʱ����ij�ܱ������а�Ͷ�ϱ�n(H2) :n ( CO2) =3:1 ����H2��CO2����Ӧ�ﵽƽ��ʱ�� ��ø���ֵ����ʵ����������¶ȱ仯��������ͼ��ʾ��

����ϵ��CO2�����ʵ����������¶ȵ�Ӱ�첻�� ԭ����_____��
��250��Cʱ����Ӧ i i ��ƽ�ⳣ��____1(����> ����< ������=��)
�����д�ʩ�У�����״����ʵ���____(����)��
A����������CO B������ѹǿ C��ѭ������ԭ���� D�������¶�
������ͼ�л���n(H2)/ n(CO2)���¶ȱ仯����ͼ_____��
(3)��Ӧi���ܵķ�Ӧ��������ͼ��ʾ��
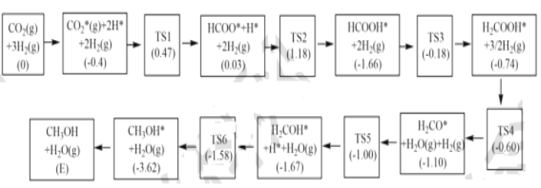
ע�������ڰ��������༰��Ŀ���������������(����������ֻ���ĸ����λ��eV)������TS��ʾ����̬��*��ʾ�����ڴ����ϵ�������Ӧ�����У����ɼ״��ľ��ٲ���ķ�Ӧ����ʽΪ__��
���𰸡�CH4 (g) +CO2 (g)2CO(g) +2H2 (g) ��H=+ ( E3-E1 ) kJmol-1 < �¶ȸı�ʱ�� ��Ӧi �ͷ�Ӧ ii ƽ���ƶ������෴ < D  HCOOH*+2H2(g) = H2COOH*+
HCOOH*+2H2(g) = H2COOH*+![]() H2
H2
��������
I��(1)���ݸ�˹������дCH4��CO2�Ʊ����ϳ��������Ȼ�ѧ����ʽ����Ӧ��������Ӧ����Ӧ���ǿ췴Ӧ����Ӧ�ٵĻ�ܴ��ڷ�Ӧ�ڣ�
II��(2) �ٷ�Ӧi.���ȡ���Ӧii���ȣ�
�ڸ���ͼʾ��250��Cʱ��CO2��H2��Ũ�ȴ���CO ��H2O��
�۸���Ӱ��ƽ���ƶ��������жϣ�
�ܸ���ͼʾ�������¶ȣ����������ʵ�����������CO2�����ʵ����������¶ȵ�Ӱ�첻��
(3)���Խ��Ӧ����Խ��������Ӧ�����ܷ�Ӧ���ʣ�
I��(1)��: CH4(g)C(ads)+2H2(g) ��H=+ ( E2-E1 ) kJmol-1
��:C(ads)+CO2(g)2CO(g) ��H=+ ( E3-E2 ) kJmol-1
���ݸ�˹���ɢ�+�ڵ��Ʊ����ϳ��������Ȼ�ѧ����ʽCH4 (g) +CO2 (g)2CO(g) +2H2 (g) ��H=+ ( E3-E1 ) kJmol-1����Ӧ�ٵĻ����E4-E1����Ӧ�ڵĻ����E5-E2����Ӧ�ٵĻ�ܴ��ڷ�Ӧ�ڣ�����(E4-E1)��(E5-E2)���ʣ�E5+E1������E4+ E2����
II��(2) �ٷ�Ӧi.���ȣ���Ӧii���ȣ��¶ȸı�ʱ�� ��Ӧi �ͷ�Ӧ ii ƽ���ƶ������෴��������ϵ��CO2�����ʵ����������¶ȵ�Ӱ�첻��
�ڷ�Ӧii��ƽ�ⳣ��![]() ������ͼʾ��250��Cʱ��CO2��H2��Ũ�ȴ���CO ��H2O������250��Cʱ����Ӧ i i ��ƽ�ⳣ����1��
������ͼʾ��250��Cʱ��CO2��H2��Ũ�ȴ���CO ��H2O������250��Cʱ����Ӧ i i ��ƽ�ⳣ����1��
��A����������CO����Ӧiii�����ƶ�������״����ʣ��ʲ�ѡA��
B������ѹǿ����Ӧi��iii�����ƶ�������״����ʣ��ʲ�ѡB��
C��ѭ������ԭ���������ԭ�����������ʣ�����״����ʣ��ʲ�ѡC��
D�������¶ȣ���Ӧi��iii�����ƶ���������״����ʣ���ѡD��
�ܸ���ͼʾ�������¶ȣ����������ʵ�����������CO2�����ʵ����������¶ȵ�Ӱ�첻���������¶����ߣ�n(H2)/ n(CO2)������ͼ�� ��
��
(3)���ݷ�Ӧ����ͼ��HCOOH*+2H2(g) = H2COOH*+![]() H2�Ļ�����Ϊ-0.18-(-1.66)=1.48����Ӧ�������������ɼ״��ľ��ٲ���ķ�Ӧ����ʽΪHCOOH*+2H2(g) = H2COOH*+
H2�Ļ�����Ϊ-0.18-(-1.66)=1.48����Ӧ�������������ɼ״��ľ��ٲ���ķ�Ӧ����ʽΪHCOOH*+2H2(g) = H2COOH*+![]() H2��
H2��

����Ŀ����1��ͨ�����ǰѲ�1molij��ѧ�������յ��������ɸû�ѧ���ļ��ܡ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H����
��ѧ�� | Si��O | Si��Cl | H��H | H��Cl | Si��Si | Si��C |
����/kJ��mol��1 | 460 | 360 | 436 | 431 | 176 | 347 |
��ش��������⣺
�ٱȽ������������ʵ��۵�ߵͣ���������������������
SiC_____________Si��SiCl4_____________SiO2
�ڹ�ҵ�ϸߴ����ͨ�����з�Ӧ��ȡ��SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)�÷�Ӧ�ķ�Ӧ�ȡ�H=_____________kJ/mol.
Si(s)+4HCl(g)�÷�Ӧ�ķ�Ӧ�ȡ�H=_____________kJ/mol.
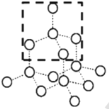
��2����֪������Na2O�ľ�����ͼ��
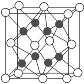
������O2-���ӵ���λ��Ϊ________��
�ڸû�������MgO��ȣ��۵�ϸߵ���________��(�ѧʽ)
����֪�û�����ľ����߳�Ϊapm����û�������ܶ�Ϊ___g��cm��3(ֻҪ���г���ʽ�����ؼ������ֵ�������ӵ���������ֵΪNA)��