题目内容
5.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
分析 ①第一份加足量NaOH溶液,加热,收集到气体0.68g,该气体为氨气,其物质的量为:$\frac{0.68g}{17g/mol}$=0.04mol,说明每份溶液中含有0.04molNH4+;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,则2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物,则原溶液中一定存在CO32-、SO42-;根据离子共存,溶液中一定不存在Ba2+;2.33g硫酸钡的物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,生成碳酸钡沉淀的物质的量为:$\frac{6.27g-2.33g}{197g/mol}$=0.02mol,0.04mol铵根离子所带正电荷与0.01mol硫酸根离子、0.02mol碳酸根离子所带负电荷相等,则不能确定溶液中是否含有氯离子和钠离子,据此进行判断.
解答 解:根据①可知生成的气体为氨气,其物质的量为:$\frac{0.68g}{17g/mol}$=0.04mol,说明每份溶液中含有0.04molNH4+;
根据②可知2.33g沉淀为硫酸钡,6.27g沉淀为硫酸钡和碳酸钡的混合物,则原溶液中一定存在CO32-、SO42-;根据离子共存,溶液中一定不存在Ba2+;2.33g硫酸钡的物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,生成碳酸钡沉淀的物质的量为:$\frac{6.27g-2.33g}{197g/mol}$=0.02mol,0.04mol铵根离子所带正电荷与0.01mol硫酸根离子、0.02mol碳酸根离子所带负电荷相等,则不能确定溶液中是否含有氯离子和钠离子,
根据分析可知,原溶液中一定存在NH4+、CO32-、SO42-;一定不存在Ba2+,可能含有Na+、Cl-,
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和麦芽糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
| A. | 55 kJ | B. | 220 kJ | C. | 550 kJ | D. | 1108 kJ |
| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
| A. | 氯化钠溶液能导电,所以氯化钠溶液是电解质 | |
| B. | 氯化钠固体不导电,所以氯化钠不是电解质 | |
| C. | 氯化氢溶液能导电,所以氯化氢是电解质 | |
| D. | 氯气溶于水能导电,所以氯气是电解质 |
| A. | 浓硫酸稀释 | B. | 氢气还原氧化铜 | ||
| C. | 氢氧化钡与氯化铵固体混合搅拌 | D. | 铝和稀硫酸反应 |
 室温下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol/L NaOH 溶液中加入0.1mol/L 的一元酸HA 溶液pH 的变化曲线如图所示.下列说法正确的是( )| A. | a 点所示溶液中c(A-)+c(HA)=0.1mol/L | |
| B. | a、b 两点所示溶液中水的电离程度不同 | |
| C. | pH=7 时,c(Na+)=c(A-)+c(HA) | |
| D. | b 点所示溶液中c(HA)>c(A-) |
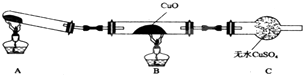 某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.
某校研究性学习小组的同学学习完氮的有关物质的性质之后,对氮元素的氢化物NH3性质的探究.