题目内容
10.用固体样品配制一定物质的量浓度的溶液,下列图示对应的有关操作规范的是( )| A. |  称量 | B. |  溶解 | C. |  转移 | D. |  定容 |
分析 A.药品不能直接放在托盘内,且药品与砝码放反了;
B.固体的溶解应在烧杯中进行;
C.移液应用玻璃棒引流;
D.胶头滴管不能深入容量瓶内.
解答 解:A.用天平称量药品,药品不能直接放在托盘内,天平称量应遵循“左物右码”,故A错误;
B.固体的溶解应在烧杯中进行,且用玻璃杯搅拌加速溶解,故B正确;
C.应用玻璃棒引流,防止溶液洒落,故C错误;
D.胶头滴管不能深入容量瓶内,应在容量瓶正上方,悬空滴加,故D错误;
故选B.
点评 本题实验考查基本操作,比较基础,旨在考查学生对基础知识的理解掌握,注意掌握中学实验常见的基本操作.

练习册系列答案
相关题目
20.以NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 标准状况下,9g H2O与11.2LO2所含的分子数均为0.5 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA | |
| C. | 常温下,14gC2H4与C3H6的混合气体中含有的氢原子总数为2NA | |
| D. | 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
1.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )
| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |
18. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A. | 0~b间的反应可用离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| B. | a点时消耗NaHSO3的物质的量为1.2 mol | |
| C. | b点到c点,KIO3与NaHSO3反应生成I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:2,加入的KIO3为1.08 mol |
5.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
2.一次区分CH3COOH、CH3CH2OH、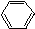 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | 溴水 | B. | Na2CO3溶液 | C. | 水 | D. | NaHSO4溶液 |
19.对下列事实的解释错误的是( )
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照条件下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 反应CuSO4+H2S═CuS↓+H2SO4说明硫化铜既不溶于水,也不溶于稀硫酸 |
20. 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
 甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )
甲烷分子中的4个氢原子都可以被取代,若甲烷分子中的4个氢原子都被苯基取代,可以得到的分子如图,对该分子的描述,不正确的是( )| A. | 分子式为C25H20 | |
| B. | 所有的碳原子不可能都在同一平面上 | |
| C. | 所有原子一定在同一平面上 | |
| D. | 此物质属于芳香烃类物质 |
