题目内容
13.下列说法不正确的是( )| A. | 甲苯和环己烯都能使酸性高锰酸钾溶液褪色 | |
| B. | 用银氨溶液可以鉴别乙醛和麦芽糖溶液 | |
| C. | 甲醛和乙二醇都可作为合成高分子化合物的单体 | |
| D. | 丙烷和2-甲基丙烷的一氯代物均为两种 |
分析 A.甲苯中甲基能被高锰酸钾氧化,环己烯含碳碳双键;
B.二者均含-CHO;
C.甲醛能制取酚醛树脂,乙二醇可以生成酯类高聚物;
D.分子中含有几种化学环境不同的H,就有几种一氯代物.
解答 解:A.环己烯中含有碳碳双键,能使高锰酸钾溶液褪色,甲苯能被高锰酸钾氧化,使其褪色,故A正确;
B.乙醛与麦芽糖中均含有醛基,均能与银氨溶液反应,故不能鉴别,故B错误;
C.甲醛与苯酚聚合生成酚醛树脂,乙二醇中含有羟基,能与羧酸发生缩聚反应生成高聚物,故C正确;
D.丙烷中含有2种H,2-甲基丙烷中也含有2种H,故丙烷和2-甲基丙烷的一氯代物均为两种,故D正确,
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)?CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2)下列说法正确的是( )
CO(g)+H2O(g)?CO2+H2(g)
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=0.40/t1mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
1.等物质的量浓度的下列稀溶液:①CH3COONa溶液;②NaHCO3溶液;③X溶液;④Ba(OH)2溶液.它们的pH依次增大,则X溶液不可能是( )
| A. | Na2CO3溶液 | B. | Na2SiO3溶液 | C. | NaOH溶液 | D. | NaHSO3溶液、 |
8.下列铁的化合物可以分别通过化合反应、置换反应、复分解反应生成的是( )
| A. | FeCl2 | B. | Fe3O4 | C. | Fe(OH)3 | D. | Fe2(SO4)3 |
18. 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
 已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3molNaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A. | 0~b间的反应可用离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ | |
| B. | a点时消耗NaHSO3的物质的量为1.2 mol | |
| C. | b点到c点,KIO3与NaHSO3反应生成I2 | |
| D. | 当溶液中I-与I2的物质的量之比为5:2,加入的KIO3为1.08 mol |
5.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
2.一次区分CH3COOH、CH3CH2OH、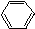 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | 溴水 | B. | Na2CO3溶液 | C. | 水 | D. | NaHSO4溶液 |
3.有四种物质的溶液:①Ba(OH)2、②Na2SO4、③HNO3、④CuCl2,不用其他试剂就可将它们逐一鉴别出来,其鉴别顺序是( )
| A. | ④①②③ | B. | ①③④② | C. | ④③②① | D. | ①④②③ |