题目内容
15.下列方法或操作正确且能达到预期目的是( )| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
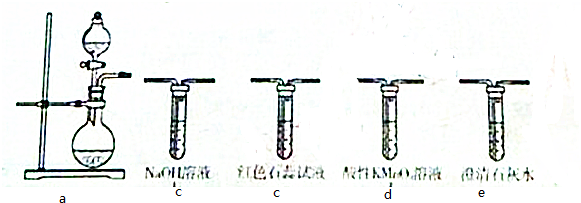
| ② | 欲证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ | 判断不同反应的反应速率的大小 | 比较不同反应的反应热数据的大小 |
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ②③⑤ |
分析 ①钠与水反应剧烈;
②碳碳双键、-CHO均能被高锰酸钾氧化;
③硫酸铜为重金属盐,使蛋白质发生变性,为不可逆过程;
④溴乙烷与NaOH溶液混合共热,发生水解反应生成溴离子,检验溴离子先加硝酸酸化;
⑤反应速率与反应热无直接关系.
解答 解:①钠与水反应剧烈,与乙醇反应较平稳,则水中羟基氢活泼,故正确;
②碳碳双键、-CHO均能被高锰酸钾氧化,则滴入KMnO4酸性溶液,看紫红色是否褪去,不能检验碳碳双键,应先加银氨溶液,再加高锰酸钾检验,故错误;
③硫酸铜为重金属盐,使蛋白质发生变性,为不可逆过程,则沉淀析出后再把沉淀加入蒸馏水中,不溶解可证明变性,故正确;
④溴乙烷与NaOH溶液混合共热,发生水解反应生成溴离子,检验溴离子先加硝酸酸化,再滴加AgNO3溶液,生成浅黄色沉淀可证明,故正确;
⑤反应速率与反应热无直接关系,反应速率大的反应热不一定大,不能利用反应速率比较反应热,故错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、有机物的结构与性质及离子检验等,把握物质的性质及反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
10.温度为25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有 WgNa2SO4•10H2O析出,若温度不变,此时剩余溶液中的溶质的质量分数为( )
| A. | $\frac{W}{W+18a}$×100% | B. | $\frac{W}{W+36a}$×100% | ||
| C. | $\frac{7100W}{161(W+18a)}$×100% | D. | $\frac{7100W}{161(W+36a)}$×100% |
7.下列分子式只表示一种物质的是( )
| A. | C2H6O | B. | C3H6O | C. | C2H3Br | D. | C2H4 Br2 |
4.下列有关FeCl3溶液叙述正确的是( )
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
5.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |