题目内容
15.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2L的正戊烷所含的分子数为0.5NA | |
| B. | 1 mol甲基中的电子数目为9NA | |
| C. | 28g乙烯所含共用电子对数目为4NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为NA |
分析 A、标况下,正戊烷为液态;
B、甲基不显电性,1个甲基中含1个C、3个H;
C、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来计算;
D、根据乙烯、丙烯和丁烯的最简式均为CH2来分析.
解答 解:A、标况下,正戊烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、甲基不显电性,故1mol甲基含9mol电子,故B正确;
C、28g乙烯的物质的量为1mol,而1mol乙烯中含6mol共用电子对,故C错误;
D、乙烯、丙烯和丁烯的最简式均为CH2,故14g混合气体中含有的CH2的物质的量n=$\frac{14g}{14g/mol}$=1mol,故含有的原子的物质的量为3mol,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
5.有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法中,正确的是( )
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
3.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
| A. | 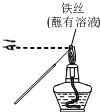 用装置甲检验溶液中是否有K+ | B. | 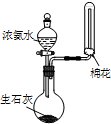 用装置乙制取并收集少量NH3 | ||
| C. | 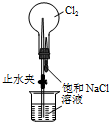 用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |
10.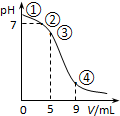 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
 25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )
25℃时,向10mL 0.1mol•L-1 CH3COONa溶液中加入0.1mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol•L-1 | |
| C. | 点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-) |
7.下列反应所得溶液中只含有一种溶质的是( )
| A. | 稀硝酸中加入过量铜片 | B. | Ca(OH)2溶液中通入Cl2 | ||
| C. | FeCl3溶液中加入过量铜片 | D. | AlCl3溶液中通入过量NaOH溶液 |