题目内容
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.标准状况下,11.2 L氟化氢所含的分子数为0.5NA |
| C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.5NA |
| D.常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为7.1g |
D
解析试题分析:A、氮气和CO的物质的量均相等,但物质的量不一定是 1mol,因此分子式不一定是NA,A不正确;B、HF的沸点是19.54℃,在标准状况下不是气态,不能适用于气体摩尔体积,B错误;C、5.6g铁是0.1mol,与足量的浓硝酸反应转移0.3mol电子,C不正确;D、KCl与NaClO中氯元素的含量相同,均是 ×100%,所以常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为
×100%,所以常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为 ×100%×14.9g=7.1g,D正确,答案选D。
×100%×14.9g=7.1g,D正确,答案选D。
考点:考查阿伏加德罗常数的有关计算

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将2molNaHCO3和一定量的Na2O2固体混合,在加热的条件下使其反应,经测定无Na2O2剩余,则最后所得固体的物质的量(n)为
| A.1mol<n≤2mol | B.1mol<n≤4mol |
| C.2mol<n≤4mol | D.n>4mol |
将35.8g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44L NO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
| A.66.4 g | B.50.8 g | C.44.8g | D.39.2g |
用NA表示阿伏伽徳罗常数的值,下列说法正确的是( )
| A.常温常压下,26g乙炔含有的∏键数目为3NA |
| B.7.8gNa2O2中所含阴离子的数目是0.2NA |
| C.标准状况下,2.24Ll8O2中所含中子的数目是2NA |
| D.在密闭容器中盛有0.lmolN2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700mL,放出2.24LNO气体(标准状况)。则该铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |
若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.铁制品上电镀锌时,阴极质量每增加65g时转移的电子数是2NA |
| B.5.6L Cl2与足量铁粉反应时转移的电子数为0.5NA |
| C.1L 1mol·L-1的CH3COOH溶液中含有H+的数目是NA |
| D.1L 0.5mol·L-1的Na2CO3溶液中含有CO32-的数目是0.5NA |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.1mol SiO2中含有NA个SiO2分子 |
| B.1mol Cu与足量的稀HNO3反应,转移2 NA个电子 |
| C.1 L0.1mol . L-1Na2CO3溶液中含有 0.1NA个CO32- |
| D.1mol苯乙烯中含有的碳碳双键数为4NA |
下列化学用语不正确的是
A.二氧化碳的电子式是: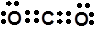 |
B.铝离子的结构示意图是:  |
C. 的中子数与质子数之差是2 的中子数与质子数之差是2 |
| D.Na2O2中的阳离子数与阴离子数之比为1:1 |