题目内容
一定质量的某铁的氧化物FexOy,与足量4 mol/L稀硝酸溶液充分反应,消耗硝酸700mL,放出2.24LNO气体(标准状况)。则该铁的氧化物的化学式为
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe8O10 |
C
解析试题分析:消耗的硝酸为4mol/L×0.7L=2.8mol,生成2.24LNO,说明作为氧化剂反应的HNO3为0.1mol,则酸性作用的HNO3为2.8mol-0.1mol=2.7mol,因为HNO3具有强氧化性,一定生成Fe(NO3)3,Fe元素共2.7mol÷3=0.9mol,根据氧化还原反应得失电子数相等,作为氧化剂的HNO3为0.1mol,被氧化的+2价铁为0.3mol,则+3价铁为0.6mol,化学式为Fe3O4。
考点: 本题考查HNO3的计算。

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 molCl2与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,2.24 L NH3中含有共价键的数目为NA |
| C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| D.标况下,11.2 L SO3所含的分子数目为0.5NA |
下列说法正确的是
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g) 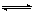 2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g)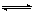 4SO3(g)的△H相等 4SO3(g)的△H相等 |
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
| A.往沸水中滴加0.1molFeCl3饱和溶液,制得的胶体中含0.1NA个Fe(OH)3胶体粒 |
| B.标准状况下,11.2L C2H6含3NA个C—H极性共价键 |
| C.标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA |
| D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
将15.2gFe、Cu组成的合金溶于过量的稀硝酸中,生成4.48LNO(标准状况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为
| A.33.2g | B.25.4g | C.22.4g | D.19.6g |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.标准状况下,11.2 L氟化氢所含的分子数为0.5NA |
| C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.5NA |
| D.常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为7.1g |
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
| A.若质量相等,则质子数相等 |
| B.若原子数相等,则中子数相等 |
| C.若分子数相等,则体积相等 |
| D.若体积相等,则密度相等 |
下列叙述中正确的是
| A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等 |
| B.标准状况下,28g CO与22.4LSO3所含分子数相等 |
| C.5.6g铁粉与足量氯气充分反应,有0.2mol电子转移 |
| D.等物质的量的CH5+和NH2-所含电子数相等 |
