题目内容
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |
B
解析试题分析:Mg、Cu最变为Mg(OH)2、Cu(OH)2,根据物质的组成可以看出,沉淀的质量等于金属的质量加上OH?的质量,而OH?的物质的量为Mg、Cu物质的量的2倍,Mg、Cu都被稀硝酸氧化为+2价,所以对应关系为:3Mg(或Cu)~2NO,由NO可得金属的物质的量为:8.96L÷22.4mol/L×3/2=0.6mol,得沉淀的质量为:26.4g+0.6mol×2×17g/mol=46.8g。
考点:本题考查根据氧化还原反应和对应关系进行的化学计算。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列表述与化学用语正确的是
A.CO2的比例模型 |
B.氢化铵的电子式: 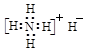 |
C.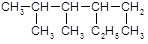 的名称:2,3-二甲基-4-乙基己烷 的名称:2,3-二甲基-4-乙基己烷 |
D.乙酸乙酯水解: |
如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)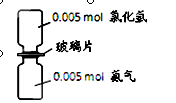
| A.反应前气体反应物的总体积为0.224 L |
| B.生成物的分子个数为0.005 NA |
| C.产物中的N-H键个数为0.02NA |
| D.加水溶解后所得溶液中NH4+数目为0.005 NA |
下列溶液中含Cl-浓度最大的是
| A.10mL 0.1mol·L-1的氯化铝溶液 |
| B.30mL 0.1mol·L-1的氯化钙溶液 |
| C.30mL 0.2mol·L-1的氯化钾溶液 |
| D.40mL 0.25mol·L-1的氯化钠溶液 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.等物质的量的N2和CO所含分子数均为NA |
| B.标准状况下,11.2 L氟化氢所含的分子数为0.5NA |
| C.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.5NA |
| D.常温常压下,14.9g KCl与NaClO的混合物中含氯元素的质量为7.1g |
下列有关化学用语使用正确的是
A.CH4分子的球棍模型: |
| B.乙烯的结构简式:CH2CH2 |
C.S的结构示意图: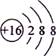 |
D.原子核内有l8个中子的氯原子: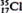 |
下列有关甲醛的化学用语表达错误的是
| A.结构简式:HCHO | B.最简式:CH2O |
C.比例模型: | D.电子式: |
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、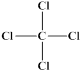 | D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
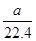 ×6.02×1023
×6.02×1023