题目内容
13.设NA表示阿伏伽德罗常数,下列说法中正确的 ( )| A. | 1mol OH-含有电子数目为9NA | |
| B. | 71g 37Cl2所含中子数目为40NA | |
| C. | 1mol铁和1mol Cl2完全反应,转移的电子数目为3NA | |
| D. | 1mol Cl2和氢氧化钠完反应,转移的电子数目为NA |
分析 A、氢氧根离子是10个电子的阴离子;
B、依据n=$\frac{m}{M}$物质的量,结合分子中含有中子数2×(37-17)=40计算分析;
C、1mol铁和1mol Cl2完全反应,2Fe+3Cl2=2FeCl3,铁有剩余,电子转移依据反应的氯气计算;
D、1mol Cl2和氢氧化钠完反应,氯元素化合价0价变化为-1价和+1价,电子转移1mol;
解答 解:A、氢氧根离子是10个电子的阴离子,1mol OH-含有电子数目为10NA,故A错误;
B、依据n=$\frac{m}{M}$物质的量=$\frac{71g}{74g/mol}$,结合分子中含有中子数2×(37-17)=40计算,含有中子数=$\frac{71}{74}$×40×NA,故B错误;
C、1mol铁和1mol Cl2完全反应,2Fe+3Cl2=2FeCl3,铁有剩余,电子转移依据反应的氯气计算,1mol Cl2完全反应电子转移2NA,故C错误;
D、1mol Cl2和氢氧化钠完反应,氯元素化合价0价变化为-1价和+1价,电子转移1mol×NA=NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数目,氧化还原反应电子转移的计算应用,主要是物质的量和微粒数的分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
3.下列离子方程式中,正确的是( )
| A. | 碳酸氢钠与硫酸氢钠反应:HCO3-+HSO4-═SO42-+H2O+CO2↑ | |
| B. | 硫酸与氢氧化钡反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 锌和稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| D. | 氧化铜和盐酸反应:O2-+2H+═H2O |
4.现有标准状况下的氮气5.6克,下列说法正确的是( )
| A. | 它的体积为2.24L | B. | 其摩尔体积为22.4L.mol-1 | ||
| C. | 含有氮分子数为0.4NA | D. | 其摩尔质量为28mol |
17.在密闭容器中,xA(g)+yB(g)?zC(g)反应达平衡时,A的浓度为0.5mol/L.若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L,则下列判断正确的是( )
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | B 的转化率增加 | D. | C 的体积分数下降 |
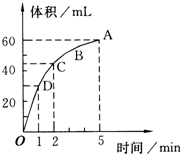 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题: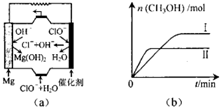 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.