题目内容
8.现有氧气与氢气的混合气体标况下体积为6.72L,混合气体的质量为6.6g,其中氧气的质量为6.4g,混合气体的平均摩尔质量为22g/mol,混合气体的物质的量之比为2:1.分析 根据n=$\frac{V}{Vm}$=$\frac{6.72L}{22.4L/mol}$=0.3mol,M=$\frac{m}{n}$计算平均摩尔质量,再根据质量之和和物质的量之和列式计算.
解答 解:n(O2)+n(H2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,
M=$\frac{m}{n}$=$\frac{6.6g}{0.3mol}$=22g/mol;
$\left\{\begin{array}{l}{n({O}_{2})×32g/mol+n({H}_{2})×2g/mol=6.6g}\\{n({O}_{2})+n({H}_{2})=0.3mol}\end{array}\right.$
解之得:n(O2)=0.2 mol,n(H2)=0.2 mol,
则m(O2)=0.2 mol×32g/mol=6.4g;
n(O2):n(H2)=0.2:0.1=2:1;
故答案为:6.4g;22g/mol;2:1.
点评 本题考查混合物的计算,题目难度不大,注意物质的量与质量、体积的计算公式的运用.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
18.在物质混合、反应等过程中,会存在“1+1≠2”的现象.通常情况下,下列各种混合或反应过程中,“1+1”不等于“2”的是( )
| A. | 1g酒精和1g水混合后的总质量 | |
| B. | 100mL酒精与100mL水混合均匀后所得溶液的总体积 | |
| C. | 温度一定时1gH2O溶解1g硝酸钾后,所得溶液的质量 | |
| D. | 1g氢氧化钠溶液和1g醋酸溶液混合后溶液的质量 |
19.设NA为阿伏伽德罗常数,下列说法不正确的是( )
| A. | 含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA | |
| B. | 4.6 g Na与稀盐酸反应,转移电子数一定为0.2NA | |
| C. | 10.6 g Na2C03晶体中含CO${\;}_{3}^{2-}$数目为0.1NA | |
| D. | 常温下,22g CO2含碳氧双键数目为NA |
16.下列说法不正确的是( )
| A. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| B. | CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 | |
| C. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| D. | 已知苹果酸的结构简式为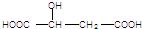 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
3.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol甲基所含有的电子数为10NA | |
| B. | 标准状况下,11.2L氯仿(CHCl3)中含有C-Cl键的数目为1.5NA | |
| C. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA | |
| D. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1 NA |
13.设NA表示阿伏伽德罗常数,下列说法中正确的 ( )
| A. | 1mol OH-含有电子数目为9NA | |
| B. | 71g 37Cl2所含中子数目为40NA | |
| C. | 1mol铁和1mol Cl2完全反应,转移的电子数目为3NA | |
| D. | 1mol Cl2和氢氧化钠完反应,转移的电子数目为NA |
12.为了除去硝酸钾晶体中所含的Ca(NO3)2、K2SO4、MgSO4,现将其配成溶液,然后加入K2CO3、Ba(OH)2、HNO3等试剂,通过过滤、蒸发等操作,制成纯净的硝酸钾晶体,其加入试剂的顺序准确的是( )
| A. | HNO3、K2CO3、Ba(OH)2 | B. | Ba(OH)2、HNO3、K2CO3 | ||
| C. | K2CO3、Ba(OH)2、HNO3 | D. | Ba(OH)2、K2CO3、HNO3 |
 .
.