题目内容
1.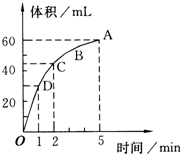 加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:
加入0.2mol的MnO2粉末于100mL过氧化氢的溶液中(密度为1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示,回答下列问题:(1)实验时放出气体的总体积为60mL.
(2)放出一半气体所需要的时间为1min.
(3)过氧化氢溶液的浓度为0.107 mol•L-1.
(4)A、B、C、D四点化学反应速率快慢的顺序为D>C>B>A.
分析 (1)反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积;
(2)反应放出气体体积为气体总体积一半为30mL,根据图象判断需要的时间;
(3)根据方程式计算生成60ml氧气所需的过氧化氢的物质的量,进而计算浓度;
(4)根据浓度对反应速率的影响判断A、B、C、D各点反应速率大小.
解答 解:(1)由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在4min后,收集到的气体体积不再增加,说明过氧化氢完全分解,由图象可知,生成氧气的体积为60mL,
故答案为:60mL;
(2)由图象可知,当时间进行到1min时,生成氧气的体积为30mL,此时生成的氧气为总体积的一半,需要的时间为1min,
故答案为:1min;
(3)根据方程式计算
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=$\frac{2mol×0.06L}{22.4L}$=0.00536mol,所以c(H2O2)=$\frac{0.00536mol}{0.05L}$=0.107 mol•L-1,
故答案为:0.107 mol•L-1;
(4)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,
故答案为:D>C>B>A.
点评 本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,正确分析图象的曲线变化是解答本题的关键.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案| A. | 摩尔既是物质的数量单位又是物质的质量单位 | |
| B. | 常温常压下,48gO2所占的体积是33.6L | |
| C. | 阿伏加德罗常数的数值就是0.012kg12C中含有的碳原子数目 | |
| D. | 把1molNaCl溶于1L水中,所得溶液物质的量浓度为1mol/L |
| A. | 蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水 | |
| B. | CH2=CH-CH(CH3)-C≡CH经催化加氢可生成3-甲基戊烷 | |
| C. | 当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 | |
| D. | 已知苹果酸的结构简式为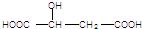 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 ,则该物质可发生氧化反应、酯化反应、缩聚反应,与HOOC-CH2-CH(OH)-COOH互为同分异构体 |
| A. | 1mol OH-含有电子数目为9NA | |
| B. | 71g 37Cl2所含中子数目为40NA | |
| C. | 1mol铁和1mol Cl2完全反应,转移的电子数目为3NA | |
| D. | 1mol Cl2和氢氧化钠完反应,转移的电子数目为NA |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |