题目内容
16. “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.(1)在汽车排放气装置中安装一个净化器可以有效地处理汽车有毒尾气.
如:CO(g)+HO2(g)═NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
则用标准状况下的4.48L CO还原NO2至N2(CO完全反应)的整个过程中放出的热量为(0.1a+0.05b)kJ(用含a和b的代数式表示).
(2)高温时,用CO还原MgSO4可制备高纯MgO.
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是2MgSO4+CO$\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3.
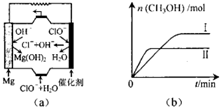
②由MgO可制成“镁一次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为Mg+ClO-+H2O=Cl-+Mg(OH)2
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
取两份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的Ⅰ、Ⅱ两个恒容密闭容器,发生上述反应.
①若测得连个容器中CH3OH的物质的量随时间变化如图(b)所示,则该反应的△H<0(填“>”“<”或“=”.下一问相同).曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”“<”或“=”).
②若350℃时,测得其中某个容器中反应达到平衡后,CO2转化率为a,则容器内的压强与起始压强之比为$\frac{(2-a)}{2}$.
分析 (1)已知:①CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
②2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
根据盖斯定律,①×2+②可得:4CO(g)+2NO2(g)═N2(g)+4CO2(g)△H=-(2a+b)kJ•mol-1,再根据CO物质的量计算放出的热量;
(2)①750℃时,CO还原MgSO4制备高纯MgO,测得气体中含等物质的量SO2和SO3,CO中碳元素化合价升高被氧化为二氧化碳;
②由原电池装置示意图可知,负极是Mg失去电子与氢氧根离子生成氢氧化镁,正极是次氯酸根获得电子,在水参与下得到氯离子、氢氧根离子,整个过程为Mg、ClO、H2O反应得到Cl-与Mg(OH)2;
(3)①由图可知,容器Ⅱ先到达平衡,故容器Ⅱ中温度较高,而平衡时甲醇的物质的量比容器I中小,说明升高温度平衡向逆反应方向移动,平衡常数减小;
②令起始加入1molCO2、3molH2,若350℃时,测得其中某个容器中反应达到平衡后,CO2转化率为a,则转化的二氧化碳为amol,计算平衡时混合气体总物质的量,恒温恒容下,压强之比等于物质的量之比.
解答 解:(1)已知:①CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ•mol-1(a>0)
②2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ•mol-1(b>0)
根据盖斯定律,①×2+②可得:4CO(g)+2NO2(g)═N2(g)+4CO2(g)△H=-(2a+b)kJ•mol-1,
标况下4.48L CO为$\frac{4.48L}{22.4L/mol}$=0.2mol,完全反应放出的热量为(2a+b)kJ×$\frac{0.2mol}{4mol}$=(0.1a+0.05b)kJ,
故答案为:(0.1a+0.05b);
(2)①750℃时,CO还原MgSO4制备高纯MgO,测得气体中含等物质的量SO2和SO3,CO中碳元素化合价升高被氧化为二氧化碳,配平后方程式为:2MgSO4+CO$\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3,
故答案为:2MgSO4+CO$\frac{\underline{\;高温\;}}{\;}$2MgO+CO2+SO2+SO3;
②由原电池装置示意图可知,负极是Mg失去电子与氢氧根离子生成氢氧化镁,正极是次氯酸根获得电子,在水参与下得到氯离子、氢氧根离子,整个过程为Mg、ClO、H2O反应得到Cl-与Mg(OH)2,该电池反应的离子方程式为:Mg+ClO-+H2O=Cl-+Mg(OH)2,
故答案为:Mg+ClO-+H2O=Cl-+Mg(OH)2;
(3)①由图可知,容器Ⅱ先到达平衡,故容器Ⅱ中温度较高,而平衡时甲醇的物质的量比容器I中小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,平衡常数减小,故△H<0,KⅠ>KⅡ,
故答案为:<;>;
②令起始加入1molCO2、3molH2,若350℃时,测得其中某个容器中反应达到平衡后,CO2转化率为a,则转化的二氧化碳为amol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol):1 3 0 0
变化量(mol):a 3a a a
平衡量(mol):1-a 3-3a a a
恒温恒容下,压强之比等于物质的量之比,则容器内的压强与起始压强之比为(1-a+3-3a+a+a):(1+3)=$\frac{(2-a)}{2}$,
故答案为:$\frac{(2-a)}{2}$.
点评 本题考查化学平衡计算及影响因素、平衡常数、反应热计算、原电池等,是对学生综合能力考查,需要学生具备扎实的基础与分析解决问题能力,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1mol OH-含有电子数目为9NA | |
| B. | 71g 37Cl2所含中子数目为40NA | |
| C. | 1mol铁和1mol Cl2完全反应,转移的电子数目为3NA | |
| D. | 1mol Cl2和氢氧化钠完反应,转移的电子数目为NA |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓))}$CH2═CH2
CH2═CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量的溴和足量的乙醇制各1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此装置各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发d.减少副产物乙醚生成
(2)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该装置各反应已经结束的最简单方法是溴的颜色完全褪去;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”);
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去;
(6)反应过程中应用冷水冷却装置D,其主要目的是避免溴大量挥发;但又不能过度冷却(如用冰水),其原因是产品1,2-二溴乙烷的沸点低,过度冷却会凝固而堵塞导管.
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 | |
| C. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,分散在空气中形成胶体 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和光导纤维 |

 如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)
如图,A、B、C、D是中学常见的混合物分离或提纯的基本装置.实验室用四氯化碳浓缩碘水的碘,宜选用上述装置中的C(填A、B、C、D)