题目内容
6.下列叙述中,正确的是( )| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |
分析 A.氢氧化钠能与玻璃中SiO2反应;
B.二氧化硅不溶于水;
C.强酸制弱酸是在常温条件下进行的;
D.制备水泥的原料是粘土和石灰石,制备玻璃的原料是纯碱、石灰石和石英.
解答 A.氢氧化钠能与玻璃中SiO2反应生成硅酸钠,硅酸钠溶液有粘性,能把瓶口和瓶塞粘在一起,所以氢氧化钠溶液不能用带玻璃塞的玻璃瓶保存,故A错误;
B.二氧化硅不溶于水与水不反应,故B错误;
C.高温下,二氧化硅能和碳酸钠反应,不能说明碳酸酸性小于硅酸,要根据常温下,强酸制取弱酸判断,故C错误;
D.制备水泥的原料是粘土和石灰石,制备玻璃的原料是纯碱、石灰石和石英,所以原料中均有石灰石即碳酸钙,故D正确;
故选:D.
点评 本题考查了二氧化硅及其用途,明确二氧化硅的性质是解答本题的关键,注意二氧化硅不溶于水,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.在下列物质中,既含离子键又含共价键的是( )
| A. | MgCl2 | B. | NaOH | C. | H2O | D. | Cl2 |
13.下列说法不正确的是( )
| A. | Al箔插入稀HNO3中无现象因Al箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | “硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触 | |
| C. | “中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用 | |
| D. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 |
14.用化学试剂鉴别下列各组物质,填写所用试剂和相应的实验现象.
| 鉴别对象 | 所用试剂 | 实验现象 |
| 苯和苯酚 | 加入FeCl3溶液 | 苯无现象,苯酚溶液呈紫色 |
| 苯和甲苯 | 加入酸性高锰酸钾溶液 | 苯不能使高锰酸钾溶液褪色,甲苯能使高锰酸钾溶液褪色 |
11.下列各组中的两种固态物质熔化或升华时,克服的微粒间相互作用力属于同种类型的是( )
| A. | 碘和氯化钾 | B. | 金刚石和冰晶石 | C. | 二氧化硅和干冰 | D. | 冰和冰醋酸 |
18.某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
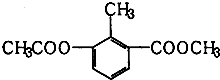

| A. | 一个分子中含有12个H原子 | B. | 该物质属于芳香族化合物 | ||
| C. | 能使酸性KMnO4溶液褪色 | D. | 苯环上的一氯代物有2种 |
15.中和热是在稀溶液中,强酸、强碱发生中和反应生成1mol水时放出的热量,中和热为57.3kJ/mol.下列热化学方程式中正确的是( )
| A. | HNO3(aq)+KOH(aq)═H2O(l)+KNO3(aq)△H>-57.3 kJ/mol | |
| B. | HNO3(aq)+NH3•H2O(aq)═H2O(l)+NH4NO3(aq)△H<-57.3 kJ/mol | |
| C. | CH3COOH(aq)+KOH(aq)═H2O(l)+CH3COOK(aq)△H<-57.3 kJ/mol | |
| D. | CH3COOH(aq)+NH3•H2O(aq)═H2O(l)+CH3COONH4(aq)△H>-57.3 kJ/mol |
16.铜~锌原电池如图所示,电解质溶液为稀硫酸,下列说法不正确的是( )
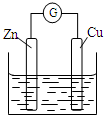

| A. | 铜电极上发生还原反应 | B. | 锌电极是原电池的负极 | ||
| C. | 电子从铜极经过外电路流向锌极 | D. | 锌电极上的反应为Zn-2e-═Zn2+ |
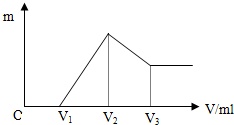 将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.