题目内容
1.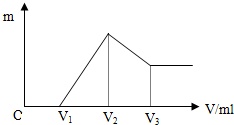 将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.
将0.1mol的镁、铝混合物溶于100ml 4mol/L的盐酸中,然后滴加NaOH溶液,在滴加NaOH溶液过程中,沉淀的质量m随加入NaOH溶液的体积V变化的关系如图所示.(1)请写出每个阶段发生反应的离子方程式:
OV1段:H++OH-=H2O
V1V2段:Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3
V2V3段:Al(OH)3+OH-=AlO2-+2H2O
(2)在滴加NaOH的过程中,若V2=400ml,则加入NaOH溶液的浓度为1mol/L.
(3)滴加上述浓度的NaOH时,若V1=160ml,则金属粉末中n(Mg)=0.06mol,
n(Al)=0.04mol,V3=440ml.
分析 (1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;
继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;
再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+OH-=AlO2-+2H2O;
(2)V2时沉淀达到最大量,此时溶质为氯化钠,根据氯原子守恒计算出氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出氢氧化钠溶液的浓度;
(3)由图可知,0~V1发生H++OH-=H2O,V1~V2发生Mg2+、Al3+转化为沉淀的反应,V2~V3段发生Al(OH)3+OH-=AlO2-+2H2O,结合反应及原子守恒计算解答.
解答 解:(1)由图可知,从开始至加入NaOH溶液V1mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后,盐酸有剩余,此时发生的反应为:H++OH-=H2O;继续滴加NaOH溶液,到氢氧化钠溶液为V2时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,此时发生的反应为:Mg2++2OH-=Mg(OH)2,Al3++3OH-=Al(OH)3,溶液为氯化钠溶液;再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应为:Al(OH)3+OH-=AlO2-+2H2O,
故答案:H++OH-=H2O;Mg2++2OH-=Mg(OH)2、Al3++3OH-=Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(2)V2时沉淀达到最大量,此时溶质为NaCl,根据氯原子守恒可知:n(NaOH)=n(HCl)=4mol/L×0.1L=0.4mol,则该氢氧化钠溶液浓度为:$\frac{0.4mol}{0.4L}$=1mol/L,
故答案为:1;
(3)若V1=160mL,说明盐酸有剩余,剩余盐酸的物质的量为:1mol/L×0.16L=0.16mol,则和金属反应的盐酸的物质的量为:4mol/L×0.1L-0.16mol=0.24mol,
设镁的物质的量是x,铝的物质的量是y,则:x+y=0.1mol,2x+3y=0.24,解得x=0.06mol,y=0.04mol,
即镁的物质的量为0.06mol,铝的物质的量为0.04mol;
V3点时溶液中的溶质是偏铝酸钠和氯化钠,根据原子守恒知,n(NaOH)=n(Al)+n(HCl)=0.04mol+0.4mol=0.44mol,所以氢氧化钠的体积为:$\frac{0.44mol}{1mol/L}$=0.44L=440mL,
故答案为:0.06; 0.04;440.
点评 本题以图象形式考查混合物计算,题目难度中等,明确每一段图象发生的化学反应及拐点代表的含义、溶液中溶质的成分为解答关键,然后结合方程式对有关问题进行分析,注意守恒思想的运用.

 阅读快车系列答案
阅读快车系列答案| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3 H2O |
| A. | 将某无色气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 | |
| B. | 取少许某溶液并滴加数滴硫氰化钾溶液,无明显现象,再滴加数滴H2O2溶液,溶液变血红色,则原溶液中一定含Fe2+ | |
| C. | 在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
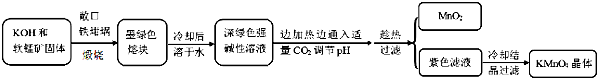
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是瓷坩埚中的二氧化硅和强碱反应,坩埚被腐蚀;实验中用铁坩锅煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-、2OH-+CO2═CO32-+H2O;

(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中a,得到的产品纯度更高.
a.醋酸b.浓盐酸c.稀硫酸.
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式:2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
(一)制备碳酸亚铁.
将一定量新制备的硫酸亚铁溶液和过量的碳酸氢铵溶液混合产生大量沉淀和气体.
(1)写出离子方程式:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(二)探究碳酸亚铁的热稳定性(加热仪器省略)
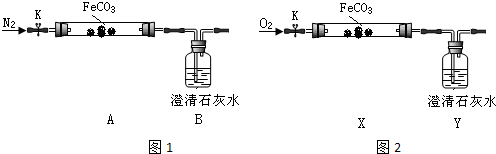
连接仪器、装药品.打开K,先通入一段时间氮气,然后,用酒精喷灯在A处加热玻璃管,观察B瓶溶液变浑浊.待固体分解完后,继续通入氮气至玻璃管冷却.
(2)先通入氮气的目的是排尽装置内空气,避免氧气干扰.B瓶现象能说明分解产物有二氧化碳.
(3)停止加热之前,是否拆开A、B之间橡胶管?答:否;理由是通入氮气,玻璃管内气压不会减小.
(三)探究碳酸亚铁还原性
【查阅资料】
①氧化亚铁是一种黑色粉末,它不稳定,在空气中加热,就迅速被氧化成四氧化三铁.
②碳酸亚铁在空气中灼烧生成氧化铁.
(4)探究碳酸亚铁和氧气反应的固体成分:
①【提出设想】
假设1 固体成分是氧化铁;
假设2 固体成分是四氧化三铁;
假设3氧化铁和四氧化三铁.
②【实验验证】连接仪器、装药品,打开止水夹K,通入氧气,加热玻璃管.Y瓶中澄清石灰水不产生沉淀时,停止加热,继续通入氧气至玻璃管冷却.
取少量玻璃管里固体于试管,滴加稀硫酸,微热,固体完全溶解.将溶液分成甲、乙两份溶液,进行后续实验.
| 实验编号 | 实验步骤 | 实验现象 |
| i | 向甲溶液滴加KSCN溶液 | 溶液变红色 |
| ii | 向乙溶液滴加酸性高锰酸钾溶液 | 溶液不褪色 |
【实验结论】根据上述实验结果,该小组得到碳酸亚铁在氧气中高温灼烧得到产物是溶液变红色,只证明有+3价铁,固体可能是氧化铁、四氧化三铁、氧化铁和四氧化三铁混合物.
(5)定量探究:取23.2g纯净固体碳酸亚铁,在空气中高温灼烧至恒重,称得固体质量净减7.2g.通过计算确定固体成分是氧化铁.
| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |
| A. | 左下方区域的金属元素 | B. | 金属和非金属分界线附近的元素 | ||
| C. | 过渡元素 | D. | 稀有气体元素 |
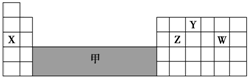
| A. | 可在灰色区域“甲”中寻找半导体材料 | |
| B. | X、Z、W 最高价氧化物对应的水化物之间两两能相互反应 | |
| C. | 气态氢化物的稳定性:Z<W | |
| D. | X只能形成一种氧化物 |
| A. | V(B2)=0.8mol/(L•s) | B. | V(D)=0.6mol/(L•s) | ||
| C. | V(C)=0.6mol/(L•s) | D. | V(A2)=0.8mol/(L•min) |