题目内容
12.在下列物质中,既含离子键又含共价键的是( )| A. | MgCl2 | B. | NaOH | C. | H2O | D. | Cl2 |
分析 活泼金属和活泼非金属元素易形成离子键,非金属元素之间易形成共价键,部分碱、大多数盐、金属氧化物、铵盐中都含有离子键,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,故A错误;
B.NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B正确;
C.水分子中H-O原子之间只存在共价键,故C错误;
D.氯气分子中Cl-Cl原子之间只存在共价键,故D错误;
故选B.
点评 本题考查离子键和共价键,侧重考查基本概念,明确物质的构成微粒及微粒之间作用力即可解答,易错选项是A,注意两个氯离子之间不存在化学键.

练习册系列答案
相关题目
2.能鉴别苯、己烯、苯酚溶液、硝酸银溶液四种溶液的试剂是( )
| A. | 盐酸 | B. | 钠 | C. | 溴水 | D. | FeCl3溶液 |
3.某反应的反应过程中能量变化如图所示(如图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
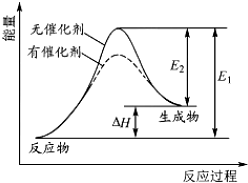

| A. | 该反应为吸热反应 | |
| B. | 催化剂能降低正反应的活化能,但不能降低逆反应的活化能 | |
| C. | 催化剂能改变反应的历程 | |
| D. | 催化剂不能改变反应的焓变 |
20.下列检验铵盐的方法中,正确的是( )
| A. | 加入氢氧化钠溶液,加热试管,再滴入酚酞试液 | |
| B. | 加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| C. | 加热试管,并用湿润的红色石蕊试纸接近试管口上方 | |
| D. | 加水溶解,再用红色石蕊试纸检验其溶液 |
7.化学变化中,反应物的总能量低于生成物的总能量的是( )
| A. | 2H2+O2 $\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| B. | CaO+H2O=Ca(OH)2 | |
| C. | CaCO3 $\frac{\underline{\;\;△\;\;}}{\;}$CaO+CO2↑ | |
| D. | CH3CH2OH(酒精)+3O2 $\frac{\underline{\;点燃\;}}{\;}$2CO2+3 H2O |
17.下列关于物质性质变化的比较,正确的是( )
| A. | Na、Mg、Al还原性依次增强 | B. | HClO4、HIO4、HBrO4酸性依次减弱 | ||
| C. | KOH、NaOH、LiOH碱性依次减弱 | D. | S、Na、O原子半径依次减小 |
4.下列说法或做法中正确的是( )
| A. | 氟氯烃的大量排放是造成酸雨的主要原因 | |
| B. | 等质量的同种煤粉和煤块完全燃烧,放出热量前者大于后者 | |
| C. | 液氯泄漏事故发生时,周边的人应该朝顺风方向逃逸或向避风的沟塘低洼处转移 | |
| D. | 火箭发动机有偏二甲肼(C2H8N2)与N2O4混合后充分燃烧,可生成CO2、N2和H2O |
1.C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2.将1.20g C跟16.0g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12L气体(标准状况),生成沉淀的质量为5.00g.下列说法正确的是( )
| A. | 反应后的固体混合物中还含有碳 | |
| B. | 反应后的固体混合物总质量为12.8 g | |
| C. | 反应后的固体混合物中氧化物的物质的量为0.05 mol | |
| D. | 反应后的固体混合物中单质Cu的质量为12.8 g |
6.下列叙述中,正确的是( )
| A. | 可用带玻璃塞的玻璃瓶盛放NaOH溶液 | |
| B. | SiO2和CO2都是酸性氧化物,既能与水反应,又能与NaOH溶液反应 | |
| C. | SiO2与纯碱在高温条件下反应生成CO2,说明硅酸的酸性比碳酸强 | |
| D. | 石灰石是工业制备普通玻璃和普通水泥的共同原料 |