题目内容
2.某校化学小组学生利用如图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO.(图中夹持装置及尾气处理装置均已略去)
(1)装置C中盛放NaOH溶液的作用是吸收乙二酸晶体受热分解生成的二氧化碳
(2)①证明分解产物中有CO2的现象是装置B中澄清石灰水变浑浊
②证明分解产物中有CO的现象是装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊
(3)实验结束后,装置F中黑色氧化铜变为红色固体.简述检验红色固体中是否含有Cu2O的实验方法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O
(4)①草酸和草酸钠(Na2C2O4)可以在酸性条件下被KMnO4、MnO2氧化.KMnO4和草酸钠在稀硫酸中反应的离子方程式是2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
②实验室常用草酸钠标定KMnO4溶液.操作如下:准确称取0.2000g草酸钠,放入锥形瓶中,加100mL稀硫酸溶解,用配置好的KMnO4溶液滴定.当加入1滴KMnO4溶液后,锥形瓶中溶液立即由无色变为紫红色,且30s不褪色,即达到滴定终点.重复上述滴定操作三次,实验数据如下表所示.
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
分析 (1)在后面的试验中要验证CO的存在,需要用NaOH溶液把二氧化碳除掉;
(2)①利用二氧化碳能使澄清石灰水变浑浊的性质来检验;
②利用CO和CuO反应生成二氧化碳的性质,来检验二氧化碳的存在,从而证明CO的存在;
(3)Cu与稀硫酸不反应,Cu2O溶于稀硫酸生成铜单质和硫酸铜;
(4)①KMnO4和草酸钠在稀硫酸中反应生成硫酸钾、硫酸锰、二氧化碳和水;根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算;
②假设KMnO4溶液的浓度为c,根据方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O计算.
解答 解:(1)在后面的试验中要验证CO的存在,需要用NaOH溶液把乙二酸晶体受热分解生成的二氧化碳除掉;
故答案为:吸收乙二酸晶体受热分解生成的二氧化碳;
(2)①二氧化碳通入装置B中,澄清石灰水变浑浊,说明有二氧化碳生成;
故答案为:装置B中澄清石灰水变浑浊;
②CO和CuO反应生成二氧化碳,二氧化碳使装置G中澄清石灰水变浑浊,先验证A中产生的二氧化碳被NaOH吸收完全,即装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
故答案为:装置D中澄清石灰水不变浑浊,装置F中黑色氧化铜变为红色固体,装置G中澄清石灰水变浑浊;
(3)Cu与稀硫酸不反应,Cu2O溶于稀硫酸生成铜单质和硫酸铜,则取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O;
故答案为:取少量固体与试管中,加稀硫酸,若溶液变蓝色,说明有Cu2O,若溶液不变色,则不含有Cu2O;
(4)①KMnO4和草酸钠在稀硫酸中反应生成硫酸钾、硫酸钠、硫酸锰、二氧化碳和水,则反应的离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②根据三次试验数据计算高锰酸钾溶液体积平均值为=$\frac{16.02+16.0+16.01}{3}$=16.01mL,假设KMnO4溶液的浓度为c,n(C2O42-)=$\frac{0.2000g}{134g/mol}$,
则:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.01601L $\frac{0.2000g}{134g/mol}$
解得c=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.
故答案为:$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.
点评 本题以已二酸的分解为背景考查了实验方案设计、氧化还原反应滴定、化学计算等,题目较为综合且具有一定难度,做题时注意把握常见物的性质及检验方法,侧重于考查学生的实验探究能力和计算能力,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案| A. | △H>0,△S>0 的反应任何条件都是非自发反应 | |
| B. | 放热反应均能自发进行,且反应放出的热量越多,反应越完全 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 水从固态→液态→气态的变化过程中△S>0 |
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | Na2O熔融状态下能导电,所以Na2O是电解质 | |
| D. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 |
①

②
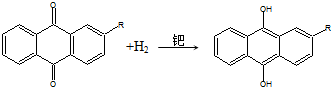
下列说法不正确的是( )
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY- 离子水解的离子方程式:HY-+H2O?H2Y+OH- | |
| C. | 该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
①加成反应
②取代反应
③聚合反应
④氧化反应.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
| A. | 干冰和金刚石 | B. | K2CO3和KCl | C. | Na2O和Na2O2 | D. | H2SO4和HCl |
 .
.