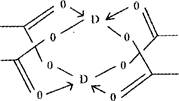
题目内容
〔化学—选修3:物质结构与性质〕(15分)
早期发现的一种天然准晶颗粒由三种Al、Cu、Fe元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体、准晶体和非晶体。
(2)基态铁原子有 个未成对电子,三价铁离子的电子排布式为: 可用硫氰化钾奉验三价铁离子,形成配合物的颜色为
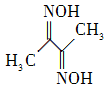
(3)新制备的氢氧化铜可将乙醛氧化为乙酸,而自身还原成氧化亚铜,乙醛中碳原子的杂化轨道类型为 ;一摩尔乙醛分子中含有的σ键的数目为: 。乙酸的沸点明显高于乙醛,其主要原因是: 。氧化亚铜为半导体材料,在其立方晶胞内部有四个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
(4)铝单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为 。列式表示铝单质的密度 g·cm-3(不必计算出结果)
(1)X射线衍射;(2)4个;血红色;(3)sp3;sp2;6NA;乙酸的分子间存在氢键,增加了分子之间的相互作用;16;(4)12;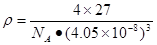
解析试题分析:(2)从外观无法区分三者,但是用X光照射会发现:晶体会对x射线发生衍射,而非晶体不会对x射线发生衍射。准晶体介于二者之间。因此通过有无衍射现象即可确定。(2)26号元素Fe核外电子排布是1s22s22p63s23p63d64s2,即可见在基态Fe原子上有4个个未成对的电子,当Fe原子失去4s的2个电子后,再失去1个3d电子就得到了Fe3+. 因此Fe3+的电子排布式是1s22s22p63s23p63d5. Fe3+与SCN-形成的多种配位化合物的颜色但是血红色的。可利用这一性质来检验Fe3+。(3)新制的Cu(OH)2在加入时可将乙醛(CH3CHO)氧化为乙酸,而它自身则被还原为砖红色的Cu2O。反应的方程式是:CH3CHO+ 2Cu(OH)2=CH3COOH+Cu2O↓+2H2O。在分子乙醛中,甲基碳原子的杂化轨道类型为上是sp3杂化 ;而醛基上碳原子是sp2杂化;乙酸的沸点明显高于乙醛,其主要原因是 乙酸的相对分子质量比乙醛大,而且在分子间存在氢键,增加了分子之间的相互作用,所以沸点比乙醛高。在Cu2O的一个晶胞中含有的O原子的个数是:4+8×1/8+6×1/2=8.由于Cu:O=2:1.因此在一个晶胞中含有的Cu原子的个数是16个。(4)在Al晶体的一个晶胞中与它距离相等且最近的Al原子在通过这个顶点的三个面心上,而通过一个顶点可以形成8个晶胞,由于每个面重复数了2次,所以在晶胞中原子的配位数为(3×8)÷2=12.在一个晶胞中含有的Al原子的个数是8×1/8+6×1/2=4.因此Al单质的密度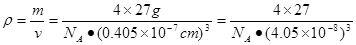 g/cm3.
g/cm3.
考点:考查晶体、非晶体、准晶体的区分方法、原子结构、离子的检验、金属晶体的密度计算的知识。

(13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
| 族 周期 | I A | IIA | IIIA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | | ③ | |
| 三 | | ④ | ⑤ | ⑥ | | | ⑦ | ⑧ |
| 四 | ⑨ | | | | | | ⑩ | |
(1)在这些元素中,⑩原子的原子结构示意图为 。
(2)写出①的最高价氧化物和②的单质的电子式 , 。
(3)用电子式表示③与④形成化合物的过程 。
(4)①的单质和⑥的氧化物反应的化学方程式 。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出 kJ的热量。
【选修3-物质结构与性质】(20分)
19-I(6分)对于钠的卤化物(NaX)和硅的卤化物(SiX4),下列叙述正确的是
| A.SiX4难水解 | B.SiX4是共价化合物 |
| C.NaX易水解 | D.NaX的熔点一般高于SiX4 |
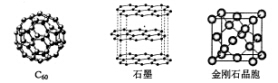
回答下列问题:
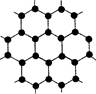
(1)金刚石、石墨、C60.碳纳米管等都是碳元素的单质形式,它们互为_____________。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____、____。
(3)C60属于____晶体,石墨属于____晶体。
(4)石墨晶体中,层内C-C键的键长为142 pm,而金刚石中C-C键的键长为154 pm。其原因是金刚石中只存在C-C间的____共价键,而石墨层内的C-C间不仅存在____共价键,还有____键。
(5)金刚石晶胞含有____个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r= ______a,列式表示碳原子在晶胞中的空间占有率____(不要求计算结果)。
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。
(15分)X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为18,中子数为10 |
| Y | Y与X同主族,且它的一种氧化物是导致酸雨的主要物质之一 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的基态原子核外有4个未成对电子 |
(2)Y的电负性比Z 的 (填“大“或”小”);X和Y的气态氢化物中,较稳定的是 (写化学式)。
(3)X的一种氢化物H2X2分子中极性键和非极性健数目之比为 。
(4)Z的一种单质与烧碱溶液作用可以生产日常生活用的消毒剂,请写出其反应的离子方程式: 。
(5)已知28gW在氧气中燃烧,放出186.4kJ的热量,请写出此反应的热化学方程式: 。