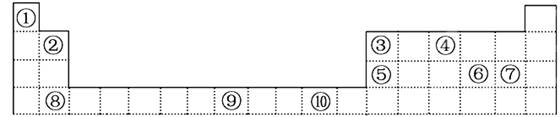
题目内容
(1)Na,Cl;(2)强;
(2)Al(OH)3,Al(OH)3+OH-===AlO2-+2H2O(3分)
(3)CH4,CO2,CO(NH2)2,BF3。
解析试题分析:(1)在上述元素中,金属性最强的在左下角,是Na,⑥~⑩是同周期元素,其原子半径越来越小,故最小的是Cl;
(2)因Cl的非金属性比S强,故氢化物HCl的热稳定性比H2S强;
(3)⑧号元素Al的最高价氧化物对应的水化物的化学式为Al(OH)3,它与⑥号元素Na的最高价氧化物对应的水化物NaOH反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O;
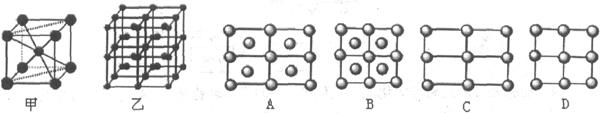
(4)图中原子的最外层的电子数是小黑点数+共价键数,由此可以提出:A是CH4,B是CO2,C是CO(NH2)2,D是BF3。
考点:元素在元素周期表的物质推断性质。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是
| A.制半导体的材料 | B.耐高温、耐腐蚀的合金材料 |
| C.制农药的材料 | D.制催化剂的材料 |
(10分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
 族 族周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | | | | ① | ② | ③ | ④ | |
| 三 | ⑤ | ⑥ | ⑦ | | | ⑧ | ⑨ | ⑩ |
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为_____>_____>____ (填元素符号),判断的实验依据是_______(写出一种)。
(12分)今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg Al | O S | MgO MgS | H2O H2S |