题目内容
3.用NA表示阿伏加德罗常数,下列说法错误的是( )| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
分析 A、HCO3-是弱酸根离子,在溶液中会水解;
B、Na2O2与足量CO2反应是歧化反应,1mol过氧化钠转移1mol电子;
C、根据在硫酸溶液中,H+和SO42-的个数之比为2:1来分析;
D、求出甲烷的物质的量,然后根据1mol甲烷含4mol共价键来分析.
解答 解:A、HCO3-是弱酸根,在溶液中会水解,故溶液中HCO3-的个数小于0.1NA个,故A错误;
B、78gNa2O2的物质的量为1mol,而Na2O2与足量CO2反应是歧化反应,1mol过氧化钠转移1mol电子,故B正确;
C、1L pH=1的硫酸溶液中,n(H+)=CV=0.1mol/L×1L=0.1mol,故SO42-的物质的量为0.05mol,个数为0.05NA个,故C正确;
D、4g甲烷的物质的量为0.25mol,而1mol甲烷含4mol共价键,故0.25mol甲烷中含1mol共价键,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
13. 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为9.8g,该混合溶液中硫酸铜的质量为16g.
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
14.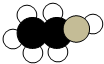 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )| A. | 能使紫色石蕊变红 | B. | 能与Na2CO3反应 | ||
| C. | 能发生酯化反应 | D. | 不能发生氧化反应 |
11. 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
 日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍.放电时,正极反应Cn(PF6)+e-═PF6-+nC,负极反应LiCn-e-═Li++nC下列有关说法中正确的是( )| A. | a极为电池的负极 | |
| B. | A-为OH- | |
| C. | 电池充电时阴极反应为:LiCn+e-═Li++nC | |
| D. | 充电时,溶液中A-从b极向a极迁移 |
18.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA | |
| D. | 标准状况下,22gCO2气体中含有的σ键和π键的数目均为2NA |
8.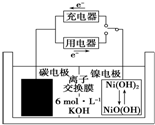 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )
 一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可作二次电池(如图所示)的碳电极.该电池的电解质溶液为6mol•L-1的KOH溶液,下列说法正确的是( )| A. | 充电时阴极发生氧化反应 | |
| B. | 充电时将碳电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-═2H+ | |
| D. | 放电时镍电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- |
15.下列表述正确的是( )
| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |