题目内容
5.电解是将电能转化为化学能,请写出用惰性电极电解硫酸铜溶液的总化学方程式2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.分析 电解池是将电能转化为化学能的装置,用惰性电解电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,据此分析解答.
解答 解:电解池是将电能转化为化学能的装置,所以电解是将电能转化为电能;
用惰性电解电解硫酸铜溶液时,阳极上氢氧根离子放电生成氧气,阴极上铜离子放电生成铜,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:电;化学; 2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
点评 本题以电解硫酸铜溶液为载体考查电解原理,明确原电池和电解池中能量变化,熟练掌握离子放电顺序,题目难度不大.

练习册系列答案
相关题目
15.甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)
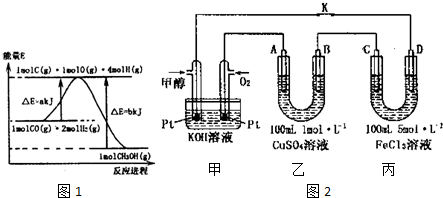
(1)合成甲醇的反应过程中物质能量变化如图1所示.写出合成甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol.
(2)实验室在lL密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L-l)
①300℃时反应开始10分钟内,H2的平均反应速率为0.08mol/(L•min);
②500℃时平衡常数K的数值为25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是cd(选填编号).
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
(3)如图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①甲中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中A极析出的气体在标准状况下的体积为2.24l;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要300mL5.0mol•L-lNaOH 溶液.

(1)合成甲醇的反应过程中物质能量变化如图1所示.写出合成甲醇的热化学方程式CO(g)+2H2(g)?CH3OH(g)△H=-(b-a)kJ/mol.
(2)实验室在lL密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol•L-l)
| 温度\时间 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
②500℃时平衡常数K的数值为25;
③300℃时,将容器的容积压缩到原来的$\frac{1}{2}$,在其他条件不变的情况下,对平衡体系产生的影响是cd(选填编号).
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时$\frac{c({H}_{2})}{c(C{H}_{3}OH)}$减小
(3)如图2是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
①甲中负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O;
②乙中A极析出的气体在标准状况下的体积为2.24l;
③反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要300mL5.0mol•L-lNaOH 溶液.
16.下列关于金属的说法中,正确的是( )
| A. | 篮球架的表面喷涂油漆,主要是为了美观 | |
| B. | 回收金属饮料罐,只是为了减少环境污染 | |
| C. | 银的导电性比铜好,所以常用银作电线而不用铜 | |
| D. | 不锈钢抗腐蚀性好,常用于制医疗器械、炊具等 |
13.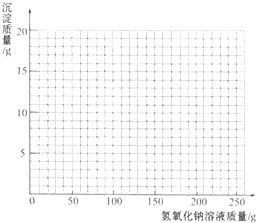 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
(1)得到沉淀的总质量为9.8g,该混合溶液中硫酸铜的质量为16g.
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
 烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:
烧杯中装有一定量硫酸和硫酸铜的混合溶液,已知该溶液中含H2SO4的质量为9.8g.某同学为测定该混合溶液中硫酸铜的质量,向烧杯中逐渐加入l0%的NaOH溶液,得到沉淀的质量记录如下:| 加入NaOH溶液的质量/g | 50.0 | 100.0 | 150.0 | 200.0 | 250.0 |
| 生成沉淀的质量/g | 0.0 | 2.5 | 8.6 | 9.8 | 9.8 |
(2)参加反应的NaOH溶液的总质量是多少克?
(3)画出在该混合溶液中加入NaOH溶液质量与生成沉淀质量变化关系的曲线.
20.洁净安全的生存环境更是健康的保障.2014年11月5日至11日,中国在北京主办今年亚太经合组织(APEC)领导人会议周,为确保北京会议期间城市空气质量优良率达到95%以上,会议周期间的空气质量状况监测中,不需要监测的指标是( )
| A. | 可吸入颗粒物(PM10) | B. | NO2浓度 | ||
| C. | SO2浓度 | D. | CO2浓度 |
10.用NaOH固体配制一定物质的量浓度的NaOH溶液时,不需要使用的玻璃仪器是( )
| A. | 玻璃棒 | B. | 容量瓶 | C. | 圆底烧瓶 | D. | 胶头滴管 |
17.下列过程不能实现化学能转化为热能的是( )
| A. | 碳酸钙受热分解 | B. | 乙烷燃烧 | ||
| C. | 铝粉与四氧化三铁反应 | D. | 铁与盐酸反应 |
14.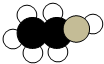 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质的说法正确的是( )| A. | 能使紫色石蕊变红 | B. | 能与Na2CO3反应 | ||
| C. | 能发生酯化反应 | D. | 不能发生氧化反应 |
15.下列表述正确的是( )
| A. | 钠和钾的合金在常温下是液体,可用于快中子反应堆作热交换剂 | |
| B. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| C. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍 | |
| D. | 高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸 |