题目内容
3.海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图: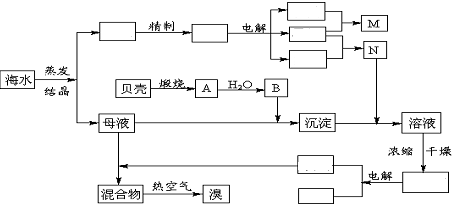
请回答:
(1)用中文填写上图空白.
(2)目前工业上主要采用离子交换膜法电解饱和食盐水,下列关于离子交换膜电解槽的叙述错误的是D.
A.精制饱和食盐水进入阳极室 B.纯水(加少量NaOH)进入阴极室
C.阴极产物为氢氧化钠和氢气 D.电解槽的阳极用金属铁网制成
(3)写出电解饱和NaCl溶液的离子反应方程式:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-.
(4)此工业煅烧贝壳得到氧化钙.石灰石和贝壳的主要成份相同,事实上,石灰石在许多化学工业生产都发挥了极大的作用,请写出一条化工生产中碳酸钙参与的化学反应方程式(此工业涉及的方程式除外)CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
(5)利用MgCl2•6H2O可制得无水氯化镁,应采取的措施是在HCl气流中加热脱水(防止MgCl2水解).
(6)用热空气吹出的溴蒸气可以用亚硫酸钠溶液吸收,写出反应的化学方程式:H2O+Na2SO3+Br2═Na2SO4+2HBr或H2O+Na2SO3+Br2═2NaBr+H2SO4.
分析 完整的实验流程为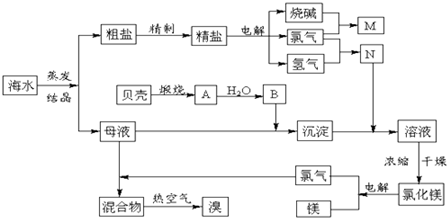 ,海水经蒸发、结晶得到粗盐,粗盐精制得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,烧碱和氯气反应可用于制备84消毒液,氢气和氯气反应可用于制备氯化氢,煅烧贝壳生成氧化钙,氧化钙和水反应生成B为氢氧化钙,母液中含有氯化镁,加入氢氧化钙生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁溶液,将溶液进行蒸发、浓缩、过滤、干燥得到氯化镁,电解熔融的氯化镁可得到氯气、镁,氯气和母液反应可生成溴,用热空气吹,可得到溴,以此解答该题.
,海水经蒸发、结晶得到粗盐,粗盐精制得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,烧碱和氯气反应可用于制备84消毒液,氢气和氯气反应可用于制备氯化氢,煅烧贝壳生成氧化钙,氧化钙和水反应生成B为氢氧化钙,母液中含有氯化镁,加入氢氧化钙生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁溶液,将溶液进行蒸发、浓缩、过滤、干燥得到氯化镁,电解熔融的氯化镁可得到氯气、镁,氯气和母液反应可生成溴,用热空气吹,可得到溴,以此解答该题.
解答 解:(1)海水经蒸发、结晶得到粗盐,粗盐精制得到精盐,电解饱和食盐水得到烧碱、氯气和氢气,烧碱和氯气反应可用于制备84消毒液,氢气和氯气反应可用于制备氯化氢,煅烧贝壳生成氧化钙,氧化钙和水反应生成B为氢氧化钙,母液中含有氯化镁,加入氢氧化钙生成氢氧化镁,氢氧化镁与盐酸反应生成氯化镁溶液,将溶液进行蒸发、浓缩、过滤、干燥得到氯化镁,电解熔融的氯化镁可得到氯气、镁,氯气和母液反应可生成溴,用热空气吹,可得到溴,则流程为 ,
,
故答案为: ;
;
(2)A.阳极是氯离子失电子发生氧化反应,精制饱和食盐水进入阳极室,故A正确;
B.阴极是氢离子得到电子生成氢气,纯水(加少量NaOH)进入阴极室,故B正确;
C.阴极是氢离子得到电子生成氢气发生还原反应,阴极附近水电离平衡破坏,氢氧根离子浓度增大结合钠离子生成氢氧化钠,故C正确;
D.电解槽的阳极是石墨电极,溶液中的氯离子失电子生成氯气,若用用金属铁网制成,则铁是电子发生氧化反应,生成的亚铁离子和氢氧根离子形成沉淀,得不到氯气和烧碱,故D错误;
故答案为:D;
(3)电解过程中阳极上氯离子失电子发生氧化反应,2Cl--2e-=Cl2↑;阴极上是氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;电解池中反应的离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;
(4)石灰石可以用作制玻璃的原料,发生的反应为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,故答案为:CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(5)氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);
(6)溴单质具有氧化性,亚硫酸钠具有还原性发生氧化还原反应生成硫酸钠和氢溴酸或生成溴化钠和硫酸;反应的化学方程式为:H2O+Na2SO3+Br2═Na2SO4+2HBr或 H2O+Na2SO3+Br2═2NaBr+H2SO4,
故答案为:H2O+Na2SO3+Br2═Na2SO4+2HBr或 H2O+Na2SO3+Br2═2NaBr+H2SO4.
点评 本题考查粗盐提纯的实验方案设计,为高频考点,侧重于学生的分析、实验能力的考查,体现化学来源于生产、生活,又服务于生产、生活的理念,学习中注意积累化学知识,才能综合应用,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | XY为0.3mol/L | B. | Y2为0.35mol/L | ||
| C. | X2为0.2mol/L | D. | X2、Y2、XY总浓度为0.6mol/L |
| A. | 2 CO(g)+O2(g)═2 CO2(g);△H=-566 KJ•mol-1 | |
| B. | CH4(g)+2 O2(g)═CO2(g)+2 H2O(l);△H=-890 KJ•mol-1 | |
| C. | H2 (g)+F2 (g)→2HF(g),△H=-270kJ•mol-1 | |
| D. | 250℃和1.01×105Pa时,反应4NO2(g)+O2(g)═2N2O5(g);△H=-56.76kJ/mol |
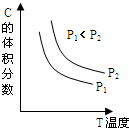 已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )
已知某可逆反应aA(g)+bB(g)?cC(g)+dD(l);△H=-E KJ•mol-1.反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如图.下列叙述正确的是( )| A. | 正反应为吸热反应 | |
| B. | 100摄氏度时,当生成cmolC,放出E KJ热量 | |
| C. | a+b<c+d | |
| D. | 降低压强,正、逆反应速率都减小 |
| A. | R为ⅡA族元素 | B. | R(OH)4是强碱 | ||
| C. | RCl2有还原性,容易被氧化 | D. | R2+的硝酸盐溶液呈中性 |
| A. | 使酚酞变红色的溶液:NH4+、Al3+、NO3-、CO32- | |
| B. | 0.1 mol•L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、NO3- | |
| D. | 由水电离出的c(H+)=10-12mol•L-1的溶液:Na+、K+、NO3-、ClO- |
 ;
; ;
;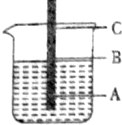 一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问:
一根铁丝插入煮沸过的蒸馏水中,铁丝上有三点,问: