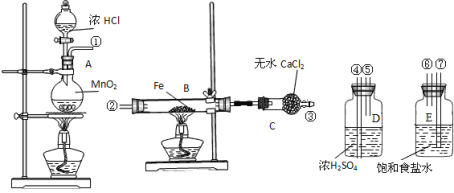
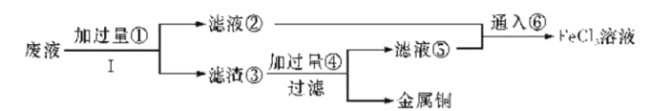
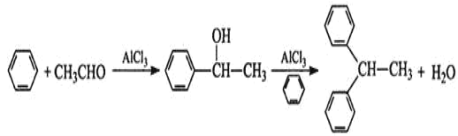
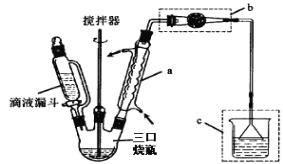
题目内容
【题目】绿原酸是咖啡的热水提取液成分之一,结构简式如图,关于绿原酸判断正确的是( )
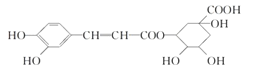
A.1mol 绿原酸与足量 NaHCO3 溶液反应,生成 3molCO2 气体
B.1mol 绿原酸与足量 Na 反应,最多消耗 6molNa
C.1mol 绿原酸与足量 NaOH 溶液反应,最多消耗 3molNaOH
D.绿原酸水解产物均可以与 FeCl3 溶液发生显色反应
【答案】B
【解析】
A.绿原酸结构中只有-COOH与碳酸氢钠反应生成二氧化碳气体,则1mol绿原酸与足量NaHCO3溶液反应,生成1molCO2气体,故A错误;
B.羟基和羧基都能与钠反应放出氢气,1mol 绿原酸与足量 Na 反应,最多消耗 6molNa,故B正确;
C.酚-OH和-COOC-、-COOH能够与NaOH反应,则1mol绿原酸与足量NaOH溶液反应,最多消耗4molNaOH,故C错误;
D.绿原酸的水解产物中含酚-OH的物质可以与FeCl3溶液发生显色反应,但含4个-OH和1个-COOH的环己烷结构不能与FeCl3溶液发生显色反应,故D错误;
故选B。

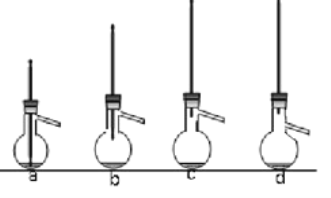
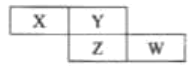
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。