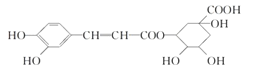
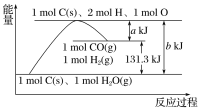
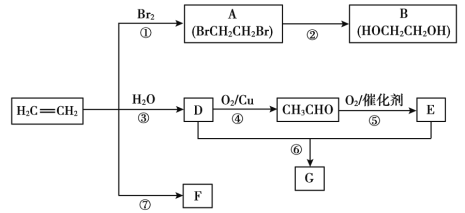
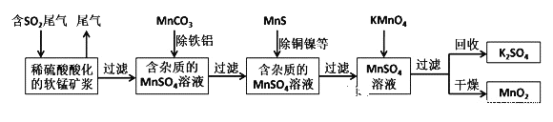
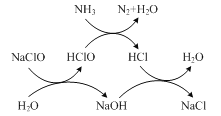
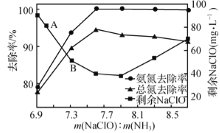
题目内容
【题目】下表是常温下几种常见弱酸的电离平衡常数:
弱酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | K=1.6×10-5 |
H2C2O4 | H2C2O4 HC2O4- | K1=5.9×10-2 K2=6.4×10-5 |
H2CO3 | H2CO3 HCO3- | K1=4.4×10-7 K2=5.6×10-11 |
H2S | H2S HS- | K1=9.1×10-8 K2=1.1×10-15 |
回答下列问题:
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,若温度不变,滴入稀硫酸使c(H+)=5.0×10-6mol/L,则由水电离出的c(H+)为___mol·L-1。
(2)下列四种离子结合H+能力最强的是___。
A.HCO3- B.C2O42- C.S2- D.CH3COO-
(3)常温下1.0mol·L-1的CH3COOH溶液中的c(H+)=___mol·L-1。
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,下列说法正确的是___。
A.溶液中n(H+)·n(OH-)保持不变
B.溶液中水电离的c(H+)·c(OH-)保持不变
C.溶液中![]() 保持不变
保持不变
D.溶液中c(OH-)增大
(5)将CH3COOH溶液加入少量Na2CO3溶液中,反应的离子方程式为___。
【答案】8×10-9 C 4.0×10-3 D 2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O
【解析】
(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,依据计算得到水的离子积常数为4.0×10-14,结合离子积常数计算得到溶液中氢氧根离子浓度,水电离出的氢氧根离子和氢离子浓度相同;
(2)弱酸的电离平衡常数越小,酸根离子结合氢离子的能力越强;
(3)根据常温下CH3COOH的电离平衡常数计算c(H+);
(4)常温下,加水稀释0.1mol·L-1的H2C2O4溶液,电离平衡正向移动,电离平衡常数不变、水的离子积常数不变;
(5)CH3COOH的酸性大于H2CO3,性将CH3COOH溶液加入少量Na2CO3溶液中生成醋酸钠、水、二氧化碳;
(1)某温度下,纯水中的c(H+)=2.0×10-7molL-1,水电离出的离子浓度c(OH-)= c(H+),则c(OH-)= c(H+)=2.0×10-7molL-1。若温度不变,滴入稀盐酸使c(H+)=5.0×10-4molL-1,Kw= c(OH-)×c(H+)=4.0×10-14,c(OH-)=![]() mol/L =8×10-9mol/L;
mol/L =8×10-9mol/L;
(2)CH3COOH的电离平衡常数是1.6×10-5、HS-的电离平衡常数是1.1×10-15、HC2O4-的电离平衡常数是6.4×10-5、H2CO3的电离平衡常数是4.4×10-7,电离平衡常数越小,酸根离子结合氢离子能力越强,结合H+能力最强的是S2-,选C;
(3)设1.0mol·L-1的CH3COOH溶液中的c(H+)=xmol·L-1。CH3COOH![]() CH3COO-+H+,忽略水电离出的H+,则溶液中c(H+)≈c(CH3COO-);弱电解质的电离是微弱的,则c(CH3COOH)=1mol·L-1,则醋酸的电离平衡常数
CH3COO-+H+,忽略水电离出的H+,则溶液中c(H+)≈c(CH3COO-);弱电解质的电离是微弱的,则c(CH3COOH)=1mol·L-1,则醋酸的电离平衡常数 ;可求得x=4.0×10-3mol·L-1;
;可求得x=4.0×10-3mol·L-1;
(4)A.c(OH-)×c(H+)不变,加水稀释体积增大,所以溶液中n(H+)·n(OH-)增大,故A错误;
B.加水稀释0.1mol·L-1的H2C2O4溶液,酸的浓度降低,水的电离程度增大,溶液中的OH-均来自水的电离,c(OH-)增大,水电离出来的OH-和H+相等,则溶液中水电离的c(H+)·c(OH-)增大,故B错误;
C.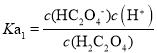 ,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中
,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中![]() 增大,故C错误;
增大,故C错误;
D.c(OH-)×c(H+)不变,加水稀释0.1mol·L-1的H2C2O4溶液,c(H+)减小,溶液中c(OH-)增大,故D正确;
答案选D;
(5)CH3COOH的酸性大于H2CO3,将CH3COOH溶液加入少量Na2CO3溶液中生成醋酸钠、水、二氧化碳,反应离子方程式是2CH3COOH+CO32-=2CH3COO-+CO2↑+H2O。

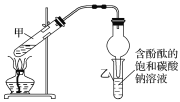
【题目】某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。
某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论)
选项 | 预测物质的化学式 | 检验需要的试剂 | 操作、现象及结论 |
A | Na2SO4 | 稀盐酸、氯化钡溶液 | 取少量该溶液于试管中,滴入稀盐酸,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,则原溶液是Na2SO4溶液 |
B | Na2CO3 | 稀盐酸、澄清的石灰水 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,则原溶液一定是Na2CO3溶液 |
C | Na2SO3 | 稀盐酸、澄清的石灰水、品红溶液 | 取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则原溶液是Na2SO3溶液 |
D | Na2SiO3 | 过量稀盐酸 | 取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,则原溶液是Na2SiO3溶液 |
A.AB.BC.CD.D