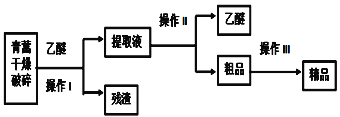
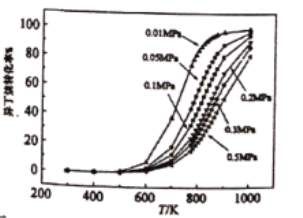
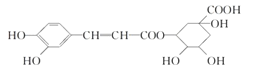
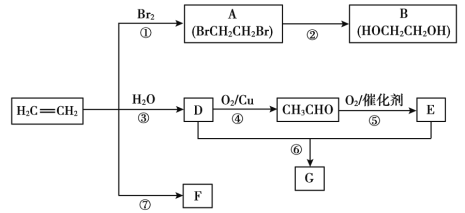
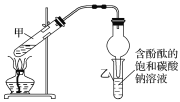
题目内容
【题目】下列说法中正确的是( )
A.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
B.1 mol Cl2中含有的原子数为NA
C.标准状况下,aL氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023个
×6.02×1023个
D.常温常压下,11.2 L CO分子数是0.5NA
【答案】C
【解析】
A.标况下水为液体,故22.4L水的物质的量不是1mol,故A错误;
B.氯气是双原子分子,故1mol氯气中含2NA个原子,故B错误;
C.标况下aL混合气体的物质的量为n=![]() mol,故分子个数N=nNA=
mol,故分子个数N=nNA=![]() ×6.02×1023个,故C正确;
×6.02×1023个,故C正确;
D.常温常压下,气体摩尔体积大于22.4L/mol,故11.2LCO的物质的量小于0.5mol,则分子个数小于0.5NA个,故D错误;
故答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____________________(填字母)。
A.c(H+) B.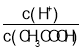 C.c(H+)c(OH﹣) D.
C.c(H+)c(OH﹣) D.![]() E.
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:______________________。
(4)25℃时,将a mol/L的醋酸与等浓度的氢氧化钠等体积混合,反应后溶液中的离子浓度由大到小关系是______________________________。