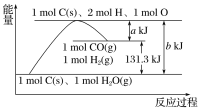
题目内容
【题目】实验室以苯、乙醛为原料,AlCl3 为催化剂制备 1,1–二苯乙烷,其反应原理为:
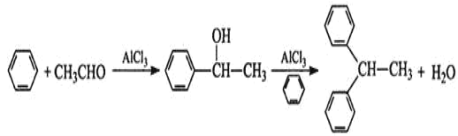
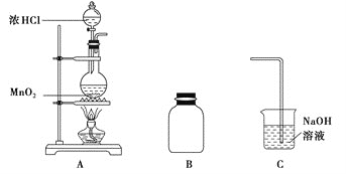
已知:AlCl3 固体遇水会发生较强烈水解。 I.制取装置如图所示。
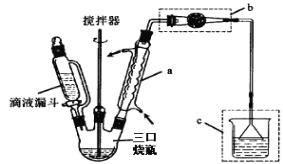
(1)该反应需控制反应温度为 20℃。控制 20℃的方法是________ ;该反应不高于 20℃ 的可能原因是:_______ 。
(2)仪器 a 的名称是 __________ 作用是 _________ ;装置 c 的作用是吸 收 HCl,写出产生 HCl 的化学方程式 ________;装置 b 的作用是 _____________ 。
Ⅱ.实验结束后,将三口烧瓶中的混合物倒入冷稀盐酸中,用分液漏斗分离出有机层,依 次用水、2%碳酸钠溶液、水洗涤,洗涤后加入少量无水硫酸镁固体,过滤、蒸馏,得到 1, 1–二苯乙烷。
(3)分液漏斗中,产品在____(填“上”或“下”)层;洗涤操作中,第二次水洗的目的 是____;无水硫酸镁也可用物质 ______________ 代替。
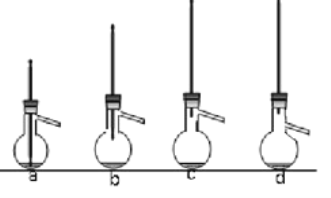
(4)蒸馏提纯时,下列装置中会导致收集到的产品中混有低沸点杂质的装置是______ (选填编号)。
(5)三口烧瓶中加入 120mL 苯(密度 0.88g/mL)、19g A1C13 和 3.7g 乙醛,20℃时充分反应, 制得纯净的 1,1–二苯乙烷 7.8g。该实验的产率约为 ___________ 。
【答案】将三口烧瓶置于 20℃的水浴中 乙醛的沸点低,温度较高,乙醛挥发,产率降低(或温度高会发生副反应) 球形冷凝管 冷凝、回流 AlCl3+3H2O ![]() Al(OH)3+3HCl 防止烧杯中的水蒸气进入反应器中与三氯化铝反应 上 洗掉氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物) 氯化钙 a、b; 51%;
Al(OH)3+3HCl 防止烧杯中的水蒸气进入反应器中与三氯化铝反应 上 洗掉氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物) 氯化钙 a、b; 51%;
【解析】
(1)乙醛的沸点低,温度较高时,乙醛挥发,使得反应产率降低,所以该反应需控制反应温度为20℃,据此分析解答;
(2)仪器a可以对反应混合物进行冷凝回流,提高反应物的利用率;根据氯化铝极易水解分析解答;
(3)1,1-二苯乙烷的密度小于水;洗涤操作中,第二次水洗主要是除去氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物),洗涤后加入少量无水硫酸镁固体,目的是吸收产品中少量的水分;
(4)蒸馏提纯时,如果温度计水银球的位置在支管口下面,收集到的馏分的沸点要低于水银球的位置在支管口处的收集到的馏分,据此分析判断;
(5)根据120mL苯(密度0.88g/mL)的物质的量和3.7g乙醛的物质的量,结合苯、乙醛为原料制备1,1-二苯乙烷的方程式进行过量判断,根据完全反应的物质计算产品的理论产量,再根据产率=![]() ×100%计算。
×100%计算。
I.(1)乙醛的沸点低,温度较高时,乙醛挥发,使得反应产率降低,所以该反应需控制反应温度为20℃,控制20℃的温度可以通过水浴的方式,即将三口烧瓶置于20℃的水浴中,故答案为:将三口烧瓶置于20℃的水浴中;乙醛的沸点低,温度较高,乙醛挥发,产率降低(或温度高会发生副反应);
(2)根据图示,仪器a为冷凝管,对反应混合物进行冷凝回流,提高反应物的利用率;氯化铝水解可得氯化氢和氢氧化铝,反应方程式为AlCl3+3H2O Al(OH)3+3HCl,氯化铝极易水解,所以要防止烧杯中的水蒸气进入三口烧瓶,引起氯化铝的水解,装置b用干燥剂吸水,防止烧杯中的水蒸气进入反应器中与三氯化铝反应,故答案为:球形冷凝管;冷凝、回流;AlCl3+3H2OAl(OH)3+3HCl;防止烧杯中的水蒸气进入反应器中与三氯化铝反应;
Ⅱ.(3)1,1-二苯乙烷的密度小于水,所以产品在上层,洗涤操作中,第二次水洗主要是除去氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物),洗涤后加入少量无水硫酸镁固体,目的是吸收产品中少量的水分,也可以用无水氯化钙代替,
故答案为:上;洗掉氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物);无水氯化钙;
(4)蒸馏提纯时,如果温度计水银球的位置在支管口下面,收集到的馏分的沸点要低于水银球的位置在支管口处的收集到的馏分,故选ab;
(5)120mL苯(密度0.88g/mL)的物质的量为![]() =1.35mol,3.7g乙醛的物质的量为
=1.35mol,3.7g乙醛的物质的量为![]() =0.084mol,根据苯、乙醛为原料制备1,1-二苯乙烷的方程式可知,苯过量,所以产品的理论产量为0.084mol×182g/mol=15.3g,所以1,1-二苯乙烷的产率约为
=0.084mol,根据苯、乙醛为原料制备1,1-二苯乙烷的方程式可知,苯过量,所以产品的理论产量为0.084mol×182g/mol=15.3g,所以1,1-二苯乙烷的产率约为![]() ×100%=51%,故答案为:51%。
×100%=51%,故答案为:51%。