题目内容
【题目】三氯化铁溶液可腐蚀印刷电路板上的铜膜,某小组为了从腐蚀废液(含有大量CuCl2、FeCl2和FeCl3)中回收铜,并将铁的化合物全部转化为溶液作为腐蚀液原料循环使用,设计了如下实验步骤:
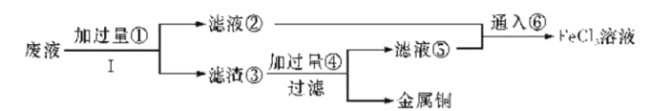
(1)写出下列物质的化学式①__、③___、⑥__。
(2)步骤Ⅰ的操作名称:___。
(3)写出FeCl3溶液与铜发生反应的离子方程式:__。
(4)向②中加入NaOH溶液并长时间暴露在空气中,先产生白色沉淀,后迅速变为灰绿色,接着又转化为___色沉淀,此过程所涉及反应的化学方程式为:___、___。
(5)通入⑥发生反应的离子方程式:___。
(6)若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是__(填字母代号)。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
【答案】Fe Cu、Fe Cl2 过滤 2Fe3++Cu=2Fe2++Cu2+ 红褐 FeCl2+2NaOH=Fe(OH)2↓+2NaCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl- B
【解析】
废液中含有大量CuCl2、FeCl2和FeCl3,加入过量的铁粉,Fe与FeCl3、CuCl2都能发生反应,过滤,滤液②中的溶质是FeCl2,滤渣③是铁和铜的混合物;滤渣③中加入足量盐酸,铁与盐酸反应生成氯化亚铁和氢气,铜不反应,过滤出金属铜,滤液⑤的溶质是FeCl2;滤液②与滤液⑤混合后通入氯气,氯化亚铁被氧化为氯化铁。
(1)根据以上分析,①是Fe;滤渣③是Cu、Fe;⑥是Cl2。
(2)步骤Ⅰ是把固体与液体分离,操作名称为过滤。
(3)FeCl3溶液与铜发生反应生成氯化亚铁和氯化铜,反应的离子方程式是2Fe3++Cu=2Fe2++Cu2+。
(4)滤液②的溶质是氯化亚铁,加入NaOH溶液,生成白色氢氧化亚铁沉淀,反应方程式是FeCl2+2NaOH=Fe(OH)2↓+2NaCl;长时间暴露在空气中,氢氧化亚铁被氧气氧化为氢氧化铁,所以迅速变为灰绿色,接着又转化为红褐色沉淀,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)氯化亚铁通入氯气生成氯化铁,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
(6)铁的还原性大于铜,若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,铁粉先与氯化铁反应,反应结束后,不可能出现的结果是有铁无铜,故选B。

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案