题目内容
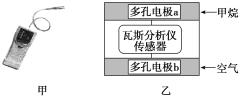
【题目】有一种瓦斯分析仪(如图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。
下列有关叙述正确的是( )
A.瓦斯分析仪工作时,电池外电路中电流由电极b流向电极a
B.电极b是正极,O2-由电极a流向电极b
C.电极a的反应式为CH4+5O2--8e-=CO32—+2H2O
D.当固体电解质中有1 mol O2-通过时,电子转移4 mol
【答案】A
【解析】
A.电池外电路中电流由正极流向负极,氧气得电子,b极为正极,A正确;
B.电极b氧气得电子,生成O2-,O2-由正极(电极b)流向负极(电极a),B错误;
C.甲烷所在电极a为负极,电极反应为CH4+4O2--8e-=CO2+2H2O,C错误;
D.1 mol O2得4 mol电子生成2 mol O2-,故当固体电解质中有1 mol O2-通过时,电子转
移2 mol,故D错误。
答案选A。

练习册系列答案
相关题目