题目内容
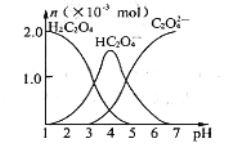
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.25℃时,欲使醋酸溶液pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
【答案】D
【解析】
试题分析:A.醋酸的电离是吸热反应,升高温度促进醋酸电离,导致醋酸电离平衡常数增大,正确;B.加水稀释促进弱酸电离,但溶液中氢离子浓度减小,温度不变,醋酸电离平衡常数不变,导致c(OH-)增大,正确;C.醋酸在溶液中存在电离平衡,向醋酸中加入CH3COONa固体,抑制醋酸电离,平衡向逆反应方向移动,正确;D.温度不变,电离平衡常数不变,所以要使电离平衡常数减小,应该改变温度,错误。

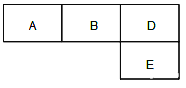
【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型 ③能与水在一定条件下反应生成C |
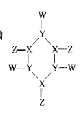
B | ①由C、H两种元素组成 ②球棍模型为 |
C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___(填字母)。
(2)A使溴的四氯化碳溶液褪色后生成产物的结构简式为___。
(3)C催化氧化生成D的化学方程式为___。
(4)有机物B具有的性质是___(填序号)。
①无色无味的液体;②有毒:③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色。
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是___(用化学方程式说明)