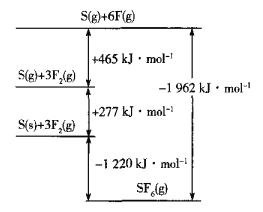
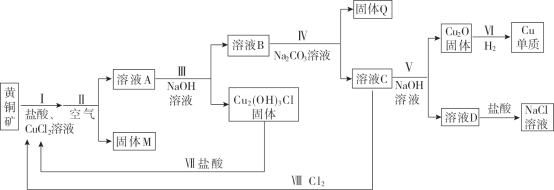
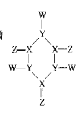
题目内容
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
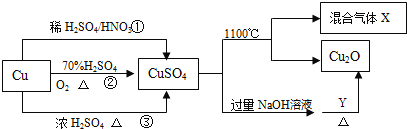
A.将CuSO4溶液蒸发浓缩、冷却结晶可制得胆矾晶体
B.相对于途径①③,途径②更好地体现了绿色化学思想
C.CuSO4在1100℃分解所得气体X可能是SO2和SO3的混合气体
D.Y可能是葡萄糖
【答案】C
【解析】
根据题意可知,本题考查铜金属及其重要化合物的主要性质,运用铜金属及其重要化合物的主要性质分析。
A.将CuSO4溶液蒸发浓缩、冷却结晶,过滤洗涤可制得胆矾晶体,故A正确;
B.相对于途径①、③,铜和浓硫酸反应会生成二氧化硫气体污染空气,与硝酸反应生成一氧化氮气体污染空气;途径②的优点:制取等质量胆矾需要的硫酸少、途径②无污染性气体产生,更好地体现了绿色化学思想,故B正确;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4═Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、氧元素化合价只有降低,无元素化合价升高,故C错误;
D.葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖,故D正确;
答案选C。

【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型 ③能与水在一定条件下反应生成C |
B | ①由C、H两种元素组成 ②球棍模型为 |
C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___(填字母)。
(2)A使溴的四氯化碳溶液褪色后生成产物的结构简式为___。
(3)C催化氧化生成D的化学方程式为___。
(4)有机物B具有的性质是___(填序号)。
①无色无味的液体;②有毒:③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色。
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是___(用化学方程式说明)