题目内容
【题目】设NA代表阿伏加德罗常数的值,下列说法错误的是( )
A.将6.4gSO2溶于水,溶液中H2SO3、HSO3-、SO32-的个数之和为0.1NA
B.![]() 和
和![]() 的混合物中所含阴离子
的混合物中所含阴离子![]() 总数为0.1NA
总数为0.1NA
C.19.2g铜完全溶于一定浓度的硝酸中,转移电子数一定为0.6NA
D.标准状况下,![]() 和
和![]() 的混合气体中所含氢原子数为3NA
的混合气体中所含氢原子数为3NA
【答案】A
【解析】
A.6.4gSO2为0.1mol,溶于水后发生SO2+H2O![]() H2SO3,H2SO3
H2SO3,H2SO3![]() H+ + HSO3-;HSO3-
H+ + HSO3-;HSO3-![]() H+ + SO32-反应,根据原子守恒,将6.4gSO2溶于水,溶液中H2SO3、HSO3-、SO32-的个数之和小于0.1NA,故A错误;
H+ + SO32-反应,根据原子守恒,将6.4gSO2溶于水,溶液中H2SO3、HSO3-、SO32-的个数之和小于0.1NA,故A错误;
B.FeS2和![]() 的摩尔质量均为120g/mol,
的摩尔质量均为120g/mol,![]() 和
和![]() 无论怎样混合,物质的量均为0.1mol,所以混合物中所含阴离子
无论怎样混合,物质的量均为0.1mol,所以混合物中所含阴离子![]() 总数为0.1NA,故B正确;
总数为0.1NA,故B正确;
C.19.2g铜为0.3 mol,完全溶于一定浓度的硝酸中,根据Cu![]() 2+
2+![]() 2e-,所以转移电子数一定为0.6NA,故C正确;
2e-,所以转移电子数一定为0.6NA,故C正确;
D.标准状况下,![]() 和
和![]() 的混合气体为 0.5mol,因为1mol乙烷和丙烯含有的氢原子数均为6 mol,所以
的混合气体为 0.5mol,因为1mol乙烷和丙烯含有的氢原子数均为6 mol,所以![]() 和
和![]() 的混合气体中所含氢原子数为3NA,故D正确。
的混合气体中所含氢原子数为3NA,故D正确。
答案选A。

 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
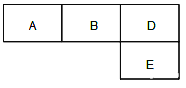
启东小题作业本系列答案【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色 ②比例模型 ③能与水在一定条件下反应生成C |
B | ①由C、H两种元素组成 ②球棍模型为 |
C | ①由C、H、O三种元素组成 ②能与Na反应 ③与E反应生成相对分子质量为88的酯 |
D | ①相对分子质量比C少2 ②能由C催化氧化得到 |
E | ①由C、H、O三种元素组成 ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___(填字母)。
(2)A使溴的四氯化碳溶液褪色后生成产物的结构简式为___。
(3)C催化氧化生成D的化学方程式为___。
(4)有机物B具有的性质是___(填序号)。
①无色无味的液体;②有毒:③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色。
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是___(用化学方程式说明)