题目内容
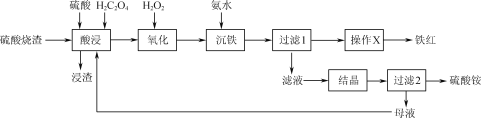
【题目】V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
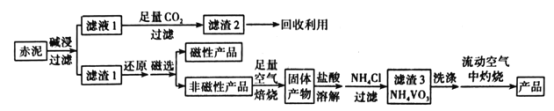
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250molL-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
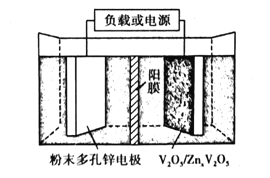
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。
【答案】加快碱浸速率并使氧化铝充分溶解 AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() 3Fe+8H++2NO
3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O AC 把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率 89.9% V2O5+xZn2++2xe-=ZnxV2O5
=3Fe2++2NO↑+4H2O AC 把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率 89.9% V2O5+xZn2++2xe-=ZnxV2O5
【解析】
赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。滤渣1系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO2+和VO3-的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5,由溶液中存在平衡VO2++H2O![]() VO3-+2H+,盐酸过量会抑制生成NH4VO3,盐酸溶解时不易过量。
VO3-+2H+,盐酸过量会抑制生成NH4VO3,盐酸溶解时不易过量。
(1)赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。“碱浸”时对赤泥进行粉碎的目的是:加快碱浸速率并使氧化铝充分溶解。滤液1中通入足量CO2时所发生主要反应的离子方程式:AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() 。故答案为:加快碱浸速率并使氧化铝充分溶解;AlO
。故答案为:加快碱浸速率并使氧化铝充分溶解;AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() ;
;
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,说明生成的是亚铁离子,该磁性产品与稀硝酸反应的离子方程式:3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O。故答案为:3Fe+8H++2NO
=3Fe2++2NO↑+4H2O。故答案为:3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O;
=3Fe2++2NO↑+4H2O;
(3)NH4VO3是白色粉末,微溶于冷水,可溶于热水,NH4VO3在NH4Cl溶液中溶解度较小,“洗涤”操作时可选用的洗涤剂有冷水或1%NH4Cl溶液,虽然NH4VO3不溶于乙醇,但NH4VO3表面杂质,如NH4Cl不溶于乙醇,使用乙醇不能洗去沉淀表面的杂质,不选用乙醇。故答案为:AC;
(4)根据信息,NH4VO4灼烧生成V2O5,因为V2O5具有强氧化性,能与具有还原性NH3发生反应,从而影响产物的纯度及产率。需在流动空气中灼烧的原因可能是把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率。故答案为:把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率;
(5)根据I2和Na2S2O3发生反应的方程式I2+2Na2S2O3═Na2S4O6+2NaI可知,消耗n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×20.00×10-3L×0.250mol·L-1=2.5×10-3mol,根据得失电子数目守恒,n(V2O5)×2×2=n(I2)×2,解得:n(V2O5)=1.25×10-3mol,则m(V2O5)=1.25×10-3×182g=0.2275g,则该产品的纯度为:
×20.00×10-3L×0.250mol·L-1=2.5×10-3mol,根据得失电子数目守恒,n(V2O5)×2×2=n(I2)×2,解得:n(V2O5)=1.25×10-3mol,则m(V2O5)=1.25×10-3×182g=0.2275g,则该产品的纯度为:![]() ×100%=89.9%;
×100%=89.9%;
故答案为:89.9%;
(6)放电时,锌作负极,失电子,V2O5在正极上得电子,发生还原反应,生成ZnxV2O5,放电时V2O5电极上的电极反应式为V2O5+xZn2++2xe-=ZnxV2O5。
故答案为:V2O5+xZn2++2xe-=ZnxV2O5。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案