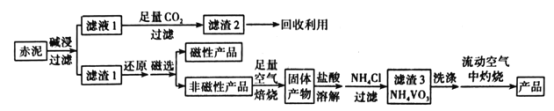
题目内容
【题目】一种利用H2C2O4(草酸)作助溶剂,酸浸提取硫酸烧渣(主要含Fe2O3、FeO、SiO2等)制备铁红并回收副产物硫酸铵的工艺流程如图:
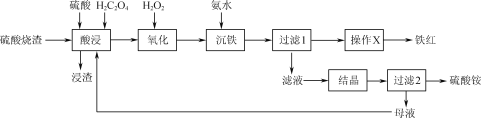
已知:H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可热分解生成CO和CO2。
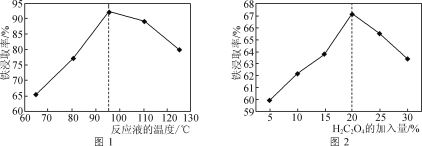
(1)用50%的硫酸“酸浸”时,反应液的温度、H2C2O4的加入量对铁浸取率的影响分别如图1、图2所示:
①“硫酸烧渣”中Fe2O3与H2SO4反应的化学方程式为___。
②图1中,反应液的温度高于95℃时,铁浸取率开始降低,其原因是___。
③图2中,H2C2O4加入量在5~20%时,铁浸取率随加入量的增大而增大,其原因是__;H2C2O4加入量超过20%时,铁浸取率反而开始降低,其原因是___。
(2)“沉铁”时发生的主要反应的离子方程式为____。
(3)由“过滤1”的滤渣制备铁红的“操作X”为___。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 体系中H2C2O4(C2O![]() )发生分解,助溶作用减弱 该范围内增大H2C2O4的量,有利于[Fe(C2O4)3]3-生成 过量的H2C2O4将酸浸液中的Fe2+转化为FeC2O4沉淀 Fe(C2O4)3]3-+3NH3·H2O=Fe(OH)3↓+3C2O
)发生分解,助溶作用减弱 该范围内增大H2C2O4的量,有利于[Fe(C2O4)3]3-生成 过量的H2C2O4将酸浸液中的Fe2+转化为FeC2O4沉淀 Fe(C2O4)3]3-+3NH3·H2O=Fe(OH)3↓+3C2O![]() +3NH
+3NH![]() 高温焙烧(或煅烧)
高温焙烧(或煅烧)
【解析】
H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可热分解生成CO和CO2。硫酸烧渣(主要含Fe2O3、FeO、SiO2等)用硫酸和草酸浸取后的溶液中含有[Fe(C2O4)3]3-,Fe2+,浸渣中主要含有二氧化硅;加入双氧水将亚铁离子氧化生成铁离子,再加入氨水将[Fe(C2O4)3]3-转化为氢氧化铁沉淀,过滤1后的滤液中主要含有硫酸铵和草酸铵,结晶得到硫酸铵晶体,母液中主要含有草酸铵,可以循环利用;过滤1的固体为氢氧化铁,热分解即可得到铁红(氧化铁),据此分析解答。
(1)①Fe2O3与H2SO4反应生成硫酸铁和水,反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②根据题意,H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可热分解生成CO和CO2。图1中,反应液的温度高于95℃时,体系中H2C2O4(C2O![]() )发生分解,助溶作用减弱,导致铁浸取率开始降低,故答案为:体系中H2C2O4(C2O
)发生分解,助溶作用减弱,导致铁浸取率开始降低,故答案为:体系中H2C2O4(C2O![]() )发生分解,助溶作用减弱;
)发生分解,助溶作用减弱;
③H2C2O4可与Fe3+生成[Fe(C2O4)3]3-,H2C2O4加入量在5~20%时,该范围内增大H2C2O4的量,有利于[Fe(C2O4)3]3-生成,使得铁浸取率随加入量的增大而增大;H2C2O4加入量超过20%时,过量的H2C2O4将酸浸液中的Fe2+转化为FeC2O4沉淀,使得铁浸取率反而开始降低,故答案为:该范围内增大H2C2O4的量,有利于[Fe(C2O4)3]3-生成;过量的H2C2O4将酸浸液中的Fe2+转化为FeC2O4沉淀;
(2)“沉铁”时氨水与[Fe(C2O4)3]3-反应生成氢氧化铁沉淀,反应的离子方程式为Fe(C2O4)3]3- +3NH3·H2O=Fe(OH)3↓+3C2O![]() +3NH
+3NH![]() ,故答案为:Fe(C2O4)3]3- +3NH3·H2O=Fe(OH)3↓+3C2O
,故答案为:Fe(C2O4)3]3- +3NH3·H2O=Fe(OH)3↓+3C2O![]() +3NH
+3NH![]() ;
;
(3)“过滤1”的滤渣为氢氧化铁,将氢氧化铁加热分解即可制备铁红,因此“操作X”为高温焙烧(或煅烧),故答案为:高温焙烧(或煅烧)。