题目内容
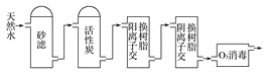
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:
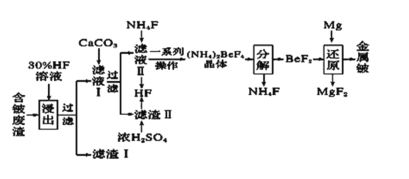
已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
【答案】粉碎废渣、增大HF溶液的浓度 适当升高温度、充分搅拌(写两项即可) Be+4HF=H2BeF4+H2↑ MgF2 HF、NH4F CaF2+H2SO4 (浓) ![]() CaSO4+2HF↑ 蒸发浓缩、冷却结晶
CaSO4+2HF↑ 蒸发浓缩、冷却结晶 ![]() 镁的还原性比铍强
镁的还原性比铍强
【解析】
将含铍废渣(主要成分是Be和MgF2)用30%HF溶液酸浸,MgF2难溶于水,所以得到的滤渣I为MgF2,根据题目信息可知滤液I中主要含有H2BeF4,过滤分离,向滤液Ⅰ中加入CaCO3,除去溶液中过量的HF,过滤得到滤渣II为 CaF2和含有H2BeF4的滤液Ⅱ,向滤液Ⅱ中加入NH4F得到(NH4)2BeF4,同时得到HF,浓硫酸和滤渣II反应也可以生成HF,得到的HF可以循环使用;经过后续一系列操作得到较纯的(NH4)2BeF4晶体,将晶体分解得到NH4F和BeF2,用Mg还原BeF2得到较纯的金属Be,NH4F则可以循环使用。
(1)粉碎废渣、增大HF溶液的浓度、适当升高温度、充分搅拌都可以提高浸出速率;反应有Be和HF,产物有H2BeF4,该过程Be元素被氧化,根据元素的价态规律可知应是H元素将Be元素氧化,所以化学方程式为Be+4HF=H2BeF4+H2↑;
(2)滤渣I主要为难溶于水的MgF2;
(3)根据分析可知循环使用的有HF和NH4F;滤渣II主要CaF2,与浓硫酸发生复分解反应生成HF,方程式为CaF2+H2SO4 (浓) ![]() CaSO4+2HF↑;(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,所以可以先加热混合溶液蒸发浓缩,再冷却析出(NH4)2BeF4晶体,所以一系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
CaSO4+2HF↑;(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,所以可以先加热混合溶液蒸发浓缩,再冷却析出(NH4)2BeF4晶体,所以一系列操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(4)BeF2在熔融状态下不能导电,说明其为共价化合物,所以电子式为![]() ;铍和镁位于同一主族,且镁位于铍的下方,所以镁的金属性比铍强,则镁的还原性比铍强,可以用金属镁制备金属铍。
;铍和镁位于同一主族,且镁位于铍的下方,所以镁的金属性比铍强,则镁的还原性比铍强,可以用金属镁制备金属铍。

 阅读快车系列答案
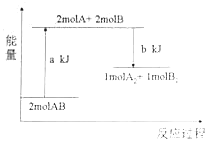
阅读快车系列答案【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。