题目内容
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
【答案】B
【解析】
A.向平衡后的容器中充入惰性气体He,不能影响任何物质的浓度,因此对化学平衡移动无影响,A错误;
B.依据平衡三段式计算
2SO3(g)![]() 2SO2(g)+O2(g) △H=+196kJ/mol
2SO2(g)+O2(g) △H=+196kJ/mol
起始量 1 0 0
变化量 0.2 0.2 0.1 19.6
平衡量 0.8 0.2 0.1
起始时向容器中充入1.0molSO2和0.50molO2,反应达到相同平衡,反应的二氧化硫物质的量为0.8mol,放热196kJ×0.4=78.4kJ,B正确;
C.充入2.0molSO3、0.50mol SO2和0.25mol O2转化为起始量相当于充入2.5molSO3,相当于将相同的平衡叠加,由于该反应的正反应是气体体积增大的反应,增大压强,平衡逆向进行,反应达到平衡前v(正)<v(逆);C错误;
D.对于同一化学反应,平衡常数只与温度有关,温度不变,化学平衡常数不变,依据A计算平衡常数K=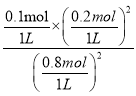 =
=![]() ;
;
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196kJ/mol平衡常数K=160,
2SO3(g) △H=-196kJ/mol平衡常数K=160,
假设按照转化率为80%计算平衡常数分析,反应的二氧化硫为2mol
2SO2(g) + O2(g)![]() 2SO3(g)
2SO3(g)
起始量 2.5 1.25 0
变化量 2.5×0.8=2 1 2
平衡量 0.5 0.25 2
K=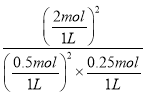 =64,不符合平衡常数,D错误;
=64,不符合平衡常数,D错误;
故合理选项是B。

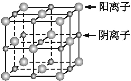
【题目】I、如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是______________。
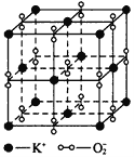
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O![]()
B.晶体中每个K+周围有8个O![]() ,每个O
,每个O![]() 周围有8个K+
周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧与-2价氧的数目比为3∶1
II、有A、B、C三种晶体,分别由C、H、Na、Cl四种元素中的一种或几种形成,对这3种晶体进行实验,结果如表所示:
项目 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与Ag+反应 |
A | 811 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
B | 3500 | 很大 | 不溶 | 不导电 | 不反应 |
C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体A的化学式为____________________。
(2)晶体B的晶体类型为____________________。
(3)晶体C中粒子间的作用力为____________________。
III、砷化镓是优良的半导体材料,可用于制作微型激光器或太阳能电池等。
(1)砷化镓的晶胞结构如下图所示,则砷化镓的化学式为____。

(2)基态As原子的核外电子排布式为_________。
(3)第一电离能:Ga____As(填“>”或“<”)。
(4)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是_________。