题目内容
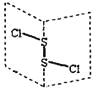
【题目】(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态价电子排布图为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
【答案】sp3 平面(正)三角形 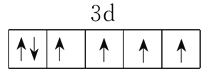 NO2 1∶2
NO2 1∶2
【解析】
(1)根据价层电子对数确定杂化类型;根据成键电子对数和孤电子对数判断空间构型;
(2)Fe原子核外有26个电子,可画出价电子排布图;
(3)用替代法找出等电子体;
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(1)SO42-中中心原子S的价层电子对数为![]() (6+2-4
(6+2-4![]() 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为
2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
答案:sp3 平面(正)三角形
(2)Fe原子核外有26个电子,根据构造原理,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6,从而可画出其价电子排布图为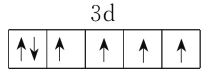 。
。
答案:
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
答案:NO2
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2;
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2;
答案:1:2

【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。