题目内容
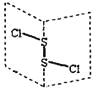
【题目】下列离子方程式表达正确的是
A. 硫化钠的水解反应:S2-+H3O+![]() HS-+H2O
HS-+H2O
B. 用铜作阳极电解氯化铜溶液:Cu2++2Cl-![]() Cu+Cl2↑
Cu+Cl2↑
C. Na2CO3溶液呈碱性的原因:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
D. 在Ba(OH)2溶液中滴加KHSO4溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O
【答案】C
【解析】
A.S2-水解,消耗水电离产生的H+,使溶液显碱性,离子方程式为S2-+H2O![]() HS-+OH-,A错误;
HS-+OH-,A错误;
B.用Cu作阳极,阳极发生氧化反应,Cu-2e-=Cu2+,在阴极上溶液中的氢离子得到电子变为H2,故电解总反应方程式为Cu+2H2O![]() Cu(OH)2+H2↑,B错误;
Cu(OH)2+H2↑,B错误;
C.Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解反应,消耗水电离产生的H+,使溶液显碱性,用离子方程式表示为:CO32-+H2O![]() HCO3-+OH-,C正确;
HCO3-+OH-,C正确;
D.在Ba(OH)2溶液中滴加KHSO4溶液至pH=7:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,D错误;
故合理选项是C。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
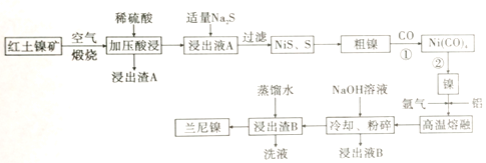
(1)煅烧时生成的主要气体产物是________ ,浸出渣A的主要成分是________。
(2)红土镍矿煅烧后生成的Ni2O3有强氧化性,加压酸浸时有无色无味的气体产生且有NiSO4生成,则该反应中氧化产物与还原产物的物质的量之比为________。
(3)向浸出液A中加入适量Na2S,发生氧化还原反应的离子方程式为________。
(4)若Na2S过量,则过滤出的固体中会混有________;H2S也可代替Na2S使用,但不利之处是________。
(5)已知Ni(CO)4的沸点是42.2℃,Ni(s)+CO(g) ![]() Ni(CO)4(g)的平衡常数与温度关系如下:
Ni(CO)4(g)的平衡常数与温度关系如下:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
步骤①、步骤②的最佳温度分别是________、 ________(选填项代号)。
A.25℃ B.30℃ C.50℃ D.80℃ E.230℃
(6)加氢氧化钠的目的是溶解部分铝,形成多孔结构的镍铝合金,已知红土镍矿中NiS质量分数45.5%,取1kg红土镍矿进行制备,熔融时加入270g铝,浸出时消耗800mL 5mol/LNaOH,理论上生成的兰尼镍的化学式为________。
【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D