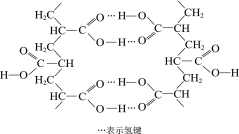
题目内容
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是__________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2溶液和0.1 mol·L-1NH4HSO4溶液中的c(![]() ),前者_____后者。(填“等于”、“大于”或“小于”)
),前者_____后者。(填“等于”、“大于”或“小于”)
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
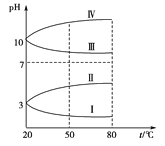
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填字母),导致pH随温度变化的原因是__________________;
②20 ℃时,0.1 mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
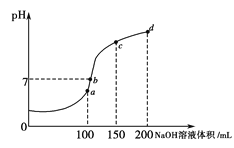
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________点;在b点,溶液中各离子浓度由大到小的排列顺序是_________________________。
【答案】NH4Al(SO4)2=NH4++Al3++2SO42- , Al3++3H2O![]() Al(OH)3(胶体)+3H+ , Al(OH)3胶体具有吸附性,吸附悬浮颗粒使其沉降,从而达到净化水的目的 小于 Ⅰ NH4Al(SO4)2水解使溶液呈酸性,升高温度使其水解程度增大,pH减小 10-3mol/L a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
Al(OH)3(胶体)+3H+ , Al(OH)3胶体具有吸附性,吸附悬浮颗粒使其沉降,从而达到净化水的目的 小于 Ⅰ NH4Al(SO4)2水解使溶液呈酸性,升高温度使其水解程度增大,pH减小 10-3mol/L a c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
【解析】
(1)Al3+水解生成的Al(OH)3具有吸附性;
(2)NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大;
②根据电荷守恒定律解题;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性。
(1)Al3+水解生成的Al(OH)3具有吸附性,离子方程式:Al3++3H2O![]() Al(OH)3+3H+,Al(OH)3,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
Al(OH)3+3H+,Al(OH)3,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2) NH4Al(SO4)2与NH4HSO4中的NH4+均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制NH4+水解,HSO4-电离出H+同样抑制NH4+水解,因为HSO4-电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中NH4+水解程度比NH4Al(SO4)2中的小,故答案为:小于;
(3)①NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ;
②根据电荷守恒,可以求出2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-)=10-3 mol/L;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3H2O,(NH4)2SO4可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3H2O三种成分,a点时c(Na+)= c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】T℃时,向1.0L恒容密闭容器中充入1.0mol SO3气体,发生反应:2SO3(g)![]() 2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
2SO2(g)+O2(g) △H=+196 kJ/mol,一段时间后达到平衡,测得此过程中从外界共吸收了19.6kJ的热量。当温度不变时,改变某一条件时,下列结论正确的是
条件改变 | 结论 | |
A | 平衡后的容器中充入1.0molHe | 平衡逆向移动,化学平衡常数减小 |
B | 起始时向容器中充入1.0molSO2 和0.50molO2 | 达到平衡时共放出78.4kJ的热量 |
C | 起始时向容器中充入2.0 molSO3、0.50 molSO2和0.25 mol O2 | 反应达到平衡前v(正)>v(逆) |
D | 起始向容器中充入2.5 molSO2 和1.25molO2 | 达到平衡时,SO2的转化率为80.0% |
A. AB. BC. CD. D
【题目】已知几种化学键的键能和热化学方程式如下:
化学键 | H—N | N—N | Cl—Cl | N | H—Cl |
键能/(kJ·mol-1) | 391 | 193 | 243 | 946 | 432 |
N2H4(g)+2Cl2(g)=N2(g)+4HCl(g) ΔH,下列推断正确的是( )
A.H(g)+Cl(g)=HCl(g) ΔH=+432kJ·mol-1
B.断裂1molCl—Cl键吸收能量比断裂1molN![]() N键多703kJ
N键多703kJ
C.上述反应中,ΔH=-431kJ·mol-1
D.上述反应中,断裂极性键和非极性键,只形成极性键
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为____。
(2)AE2的电子式为___。
(3)C、E、F的单质沸点最低的是__(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___(填离子符号)。
(5)实验室制取F2气体的离子方程式为___。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____。