��Ŀ����
15�������ҹ����Ԫ�أ�������ƻ�����������˷�Ӧ����Ҫ���ϣ���1����Ԫ��ԭ������Ϊ42����д�����ĺ�������Ų�ʽ��1s22s22p63s23p63d104s24p64d55s1�������ڱ��У����ڵ������ڢ�B�壮
��2�����������������������������ԭ�Ӱ뾶Ϊ136pm�����ԭ������Ϊ95.94����þ�������ܶ�Ϊ10.3g/cm3������Ŀռ�������Ϊ68%��
��3�������γ����˴غ����һ���⺬±����[Mo6Cl8]4+��6�����γɰ�����Ǽܣ���ԭ�������Ż�����ԭ�����������������8��Cl-�Ŀռ乹��Ϊ�����壻
��4�������������Ҫ�������ɷ���ҪΪMoS2��������403K��202650Pa�£������Լ���Һ��Ӧ��������MoO42-���ͽ�����Һ����Ҳ����������Һ��д���÷�Ӧ�����ӷ���ʽ��MoS2+9O2+12OH-=2MoO42-+4SO42-+6H2O��
��5�����ܱ������У���ϡ�������ܽ���������������423-523K��1114575-1823850Pa��ѹ�½��У���Ӧ������������γɴ��ڣ�����������ᣩ�������Ἰ��û�����ģ��൱�ڴ��������û�ѧ����ʽ���Խ��ͣ�MoS2+6HNO3=H2MoO4��+2H2SO4+6NO����2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��
���� ��1������42��Ԫ�أ�����ԭ�Ӻ�������Ų�������д��������Ų�ʽ���������5�����Ӳ㣬�۵�����Ϊ6��
��2���������������������������������ÿ�������к�����ԭ����Ϊ1+$8��\frac{1}{8}$=2��$��=\frac{m}{V}$�����ܶȣ����ݿռ�������=$\frac{��ԭ�ӵ������}{�������}$��100%���㾧��Ŀռ������ʣ�
��3��һ���⺬±����[Mo6Cl8]4+��6�����γɰ�����Ǽܣ���ԭ�������Ż�����ԭ���������ṹͼΪ ���ݴ��жϣ�
���ݴ��жϣ�
��4������Ԫ���غ�͵���غ���д���ӷ���ʽ��
��5����ϡ�������ܽ��������ᱻ��ԭ��һ��������һ�������ֿ��Ա����������������ɶ�����������ˮ���γ����ᣮ
��� �⣺��1������42��Ԫ�أ�����ԭ�Ӻ�������Ų����ɿ�֪���������Ų�ʽΪ1s22s22p63s23p63d104s24p64d55s1���������5�����Ӳ㣬�۵�����Ϊ6���������Ԫ�����ڱ��е������ڵڢ�B�壬
�ʴ�Ϊ��1s22s22p63s23p63d104s24p64d55s1���壻��B��
��2���������������������������������ÿ�������к�����ԭ����Ϊ1+$8��\frac{1}{8}$=2������������������ԭ�ӵİ뾶Ϊ������Խ��ߵ�$\frac{1}{4}$����ԭ�Ӱ뾶Ϊ136pm�����Ծ����ı߳�Ϊ$\frac{4��136}{\sqrt{3}}$pm�����ܶ�$��=\frac{m}{V}$=$\frac{\frac{2��95.94}{6.02��1{0}^{23}}}{��\frac{4��136}{\sqrt{3}}{��1{0}^{-10}��}^{3}}$g/cm3=10.3g/cm3���ռ�������=$\frac{��ԭ�ӵ������}{�������}$��100%=$\frac{2��\frac{4}{3}�У�136pm��^{3}}{��\frac{4��136}{\sqrt{3}}pm��^{3}}$100%=68%��
�ʴ�Ϊ��10.3g/cm3��68%��
��3��һ���⺬±����[Mo6Cl8]4+��6�����γɰ�����Ǽܣ���ԭ�������Ż�����ԭ���������ṹͼΪ �����Ը�������8��Cl-�Ŀռ乹��Ϊ�����壬
�����Ը�������8��Cl-�Ŀռ乹��Ϊ�����壬
�ʴ�Ϊ�������壻
��4������Ԫ���غ�͵���غ��֪��MoS2����Լ���Һ��Ӧ�����ӷ���ʽΪMoS2+9O2+12OH-=2MoO42-+4SO42-+6H2O��
�ʴ�Ϊ��MoS2+9O2+12OH-=2MoO42-+4SO42-+6H2O��
��5����ϡ�������ܽ��������ᱻ��ԭ��һ��������һ�������ֿ��Ա����������������ɶ�����������ˮ���γ����ᣬ��Ӧ�����еĻ�ѧ����ʽΪMoS2+6HNO3=H2MoO4��+2H2SO4+6NO����2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��
�ʴ�Ϊ��MoS2+6HNO3=H2MoO4��+2H2SO4+6NO����2NO+O2=2NO2��3NO2+H2O=2HNO3+NO��
���� ������Ҫ�����˺�������Ų���Ԫ�����ڱ��������ļ��㡢�����Ľṹ�����ӷ�Ӧ��������ԭ��Ӧ��֪ʶ���ѶȽϴ�ѧ���Ŀռ������������ʽṹ�Ļ���֪ʶҪ��ϸߣ�

 �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�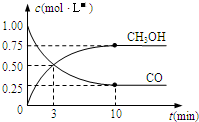 CO��Ӧ�ú������ǵ��������ȵ����⣮
CO��Ӧ�ú������ǵ��������ȵ����⣮��1��CO�ܵ�����ϵ�����ж�����ҵ�ϳ���SO2��ȥԭ����������CO��������Ϊ����S��CO2��д���÷�Ӧ�Ļ�ѧ����ʽΪ2CO+SO2=2CO2+S��
��2��������Ӧ�У�ÿ����2.24L���壨��״���£���ת�Ƶ�����Ϊ0.4NA��
CO��ҵ�Ͽ����ڸ�¯�������������·�Ӧ��$\frac{1}{3}$Fe2O3��s��+CO��g��?$\frac{2}{3}$Fe��s��+CO2��g����
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�������
| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
a���÷�Ӧ��һ�����ȷ�Ӧ
b���÷�Ӧ��ƽ�ⳣ������ʽ��K=$\frac{c��C{O}_{2}��}{c��CO��}$
c�������������䣬��ƽ����ϵ����CO2���壬Kֵ��С
d����Kֵ����1ʱ����Ӧ�ﵽƽ��
��4�������CO��ƽ��ת���ʣ��ٽ�Fe2O3��ת�����ɲ�ȡ�Ĵ�ʩ��a��ѡ����ţ�
a����ʱ���ջ��Ƴ�CO2
b������Ӧ��ϵ��ѹǿ
c���ø���Ч�Ĵ���
d�������ʯ������Ӵ����
��¯���������ķ����е�CO�ɽ��л��գ�ʹ����һ�������º�H2��Ӧ�Ʊ��״���CO��g��+2H2��g��?CH3OH��g��+Q
��5������ͼ���Կ�������Ӧ��ʼ��ƽ�⣬��Ӧ����v��H2��=0.15mol/��L•min����
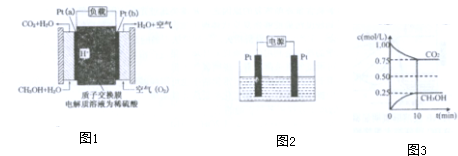
��6���״����������ɼ��ᣬ��ʹ0.1mol/L�ļ�����Һ�ĵ������pHֵ���������ad��ѡ����ţ�
a����ˮϡ�� b���������������ƹ��� c��ͨ�Ȼ��� d���������������ƹ��壮
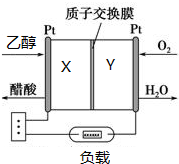 �����Ҵ��������������Ƕ��Ҵ�ȼ�ϵ�ص��о���������Ȥ����ͼ��ʾΪij���Ҵ�ȼ�ϵ�صĹ���ԭ��������˵����ȷ���ǣ�������
�����Ҵ��������������Ƕ��Ҵ�ȼ�ϵ�ص��о���������Ȥ����ͼ��ʾΪij���Ҵ�ȼ�ϵ�صĹ���ԭ��������˵����ȷ���ǣ�������| A�� | Y���ĵ缫��ӦʽΪO2+4e-+2H2O�T4OH- | |
| B�� | ��طŵ�ʱ��H+��Y��������X���� | |
| C�� | ÿ����1mol�Ҵ���ת�Ƶ���4mol | |
| D�� | �øõ������Դ��⾫��ͭ��X��Ӧ���ͭ���� |
| A�� | a��c��d��b | B�� | d��a��b��c | C�� | d��b��a��c | D�� | b��a��d��c |
| A�� |  | B�� |  | C�� | 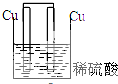 | D�� | 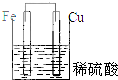 |
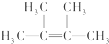 ��������2��3-����-2-��ϩ��
��������2��3-����-2-��ϩ�� ��
��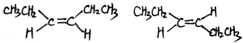 ����CH3CH2��2C=CH2��
����CH3CH2��2C=CH2��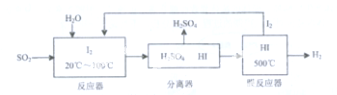
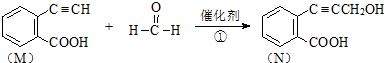
 ���������۷�Ӧ����Ľṹ��ʽΪ
���������۷�Ӧ����Ľṹ��ʽΪ ��P���ʵ��������ʵ�����������Ϊ����ȩQ����Q��������Һ������Ӧ�Ļ�ѧ����ʽΪ
��P���ʵ��������ʵ�����������Ϊ����ȩQ����Q��������Һ������Ӧ�Ļ�ѧ����ʽΪ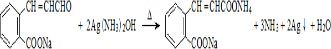 ��
��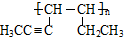
 ��A��B���Է������Ƣٵķ�Ӧ�����л������÷�Ӧ�Ļ�ѧ����ʽΪ
��A��B���Է������Ƣٵķ�Ӧ�����л������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��