题目内容
10. CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.(1)CO能导致镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2.写出该反应的化学方程式为2CO+SO2=2CO2+S.
(2)上述反应中,每减少2.24L气体(标准状况下),转移电子数为0.4NA.
CO工业上可用于高炉炼铁,发生如下反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),
已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
a.该反应是一个放热反应
b.该反应的平衡常数表达式是K=$\frac{c(C{O}_{2})}{c(CO)}$
c.其他条件不变,向平衡体系充入CO2气体,K值减小
d.当K值等于1时,反应达到平衡
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是a(选填序号)
a.及时吸收或移出CO2
b.增大反应体系的压强
c.用更高效的催化剂
d.粉碎矿石,增大接触面积
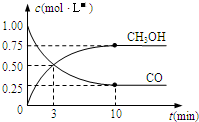
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)+Q
(5)从上图可以看出,反应开始到平衡,反应速率v(H2)=0.15mol/(L•min).
(6)甲醇氧化可生成甲酸,能使0.1mol/L的甲酸溶液的电离度与pH值都增大的是ad(选填序号)
a.加水稀释 b.加入少量甲酸钠固体 c.通氯化氢 d.加入少量苛性钠固体.
分析 (1)SO2与CO反应,生成固体S和CO2,据原子守恒和电子守恒书写化学方程式;
(2)据1molCO反应转移2mol电子,1molSO2反应,转移4mol电子分析;
(3)a、随温度升高K增大,说明正反应吸热;
b、化学平衡常数K=$\frac{生成物浓度度系数幂次方}{反应物浓度系数幂次方}$,固体不列入;
c、化学平衡常数只受温度影响;
d、图表中没有K=1的情况,K=1不知是否平衡;
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,需要平衡正向移动,据此分析;
(5)根据图象中甲醇浓度变化量求出氢气的浓度变化量,再根据v=$\frac{△c}{△t}$计算氢气的反应速率;
(6)据影响弱酸电离平衡移动的因素分析.
解答 解:(1)SO2与CO反应,生成固体S和CO2,1molCO反应转移2mol电子,1molSO2反应,转移4mol电子,所以其化学计量数之比为2:1,化学方程式为:2CO+SO2=2CO2+S,故答案为:2CO+SO2=2CO2+S;
(2)1molCO反应转移2mol电子,1molSO2反应,转移4mol电子,标准状况下2.24L气体为0.1mol,每反应0.1mol二氧化硫,转移电子0.4mol,电子数为0.4NA,故答案为:0.4NA;
(3)a、随温度升高K增大,说明正反应吸热,故正确;
b、化学平衡常数K=$\frac{生成物浓度度系数幂次方}{反应物浓度系数幂次方}$=$\frac{[C{O}_{2}]}{[CO]}$,故正确;
c、化学平衡常数只受温度影响,故错误;
d、图表中没有K=1的情况,K=1不知是否平衡,故错误;
故答案为:cd;
(4)a.及时吸收或移出CO2,平衡正向移动,反应物转化率增大,故正确;
b.增大反应体系的压强,平衡不移动,故错误;
c.用更高效的催化剂,只能加快反应速率,不影响平衡移动,故错误;
d.粉碎矿石,增大接触面积,只能加快反应速率,不影响平衡移动,故错误;
故答案为:a;
(5)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则△c(H2)=2×0.75mol/L=1.5mol/L,v(H2)=$\frac{1.5mol/L}{10min}$=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(6)a.加水稀释促进甲酸电离,但溶液酸性减弱,故正确;
b.加入少量甲酸钠固体,甲酸根离子浓度增大,甲酸电离平衡逆向移动,电离度减小,故错误;
c.通氯化氢,氢离子浓度增大,甲酸电离平衡逆向移动,电离度减小,故错误;
d.加入少量苛性钠固体,与甲酸发生中和反应,甲酸电离度增大,溶液酸性减弱,故正确;
故答案为:ad.
点评 本题考查范围广,知识跨度大,考查了氧化还原反应方程式书写及电子转移数目计算、化学平衡移动、化学反应速率计算、弱酸电离平衡移动.

| A. | H2和CO2 | B. | CO2和H2O | C. | CO和CH3OH | D. | CH3OH和H2 |
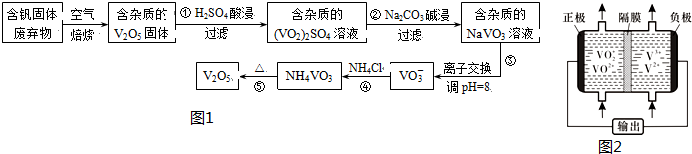
部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
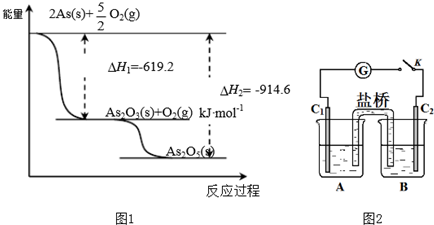
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
| A. | 加热时间太短 | B. | 不应冷却后再滴入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀HNO3酸化 | D. | 加AgNO3溶液后未加稀HNO3 |
| A. | 两者消耗NaOH的物质的量相同 | |
| B. | 中和HCl消耗NaOH的物质的量多 | |
| C. | 中和CH3COOH消耗NaOH的物质的量多 | |
| D. | 两者消耗NaOH的物质的量无法比较 |
| A. | Br2 | B. | CO2 | C. | NaCl | D. | HCl |
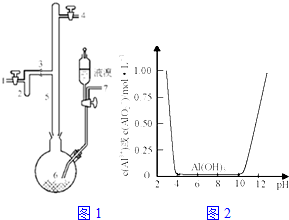 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.