题目内容
3.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )| A. | 若R(OH)n为强碱,则W(OH)n+1也为强碱 | |
| B. | 若最高氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
分析 A.同周期元素从左到右元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性减弱;
B.HnXOm为强酸,则X为N或S,同周期元素从左到右元素非金属性逐渐增强;
C.若Y的最低化合价为-2,则Y处于ⅦA族;
D.若X的最高正化合价为+5,当X为P,则R一定为金属元素.
解答 解:A.同周期元素从左到右元素的金属性逐渐减弱,若R(OH)n为强碱,则W(OH)m不一定为强碱,故A错误;
B.HnXOm为强酸,则X为N或S,同周期元素从左到右元素非金属性逐渐增强,Y是活泼非金属元素,故B正确;
C.若Y的最低化合价为-2,则Y处于ⅦA族,Z的最低价为-1价,其最高正化合价为+7(F元素除外),故C错误;
D.X的最高正化合价为+5,当X为P,则R一定为金属元素,故D错误.
故选B.
点评 本题考查同周期元素的性质的递变规律,注意把握同周期元素的性质的递变规律和在元素周期表中的可能位置,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.某化学兴趣小组在一次实验活动中发现钠能在二氧化碳中燃烧,他们对钠在二氧化碳气体中燃烧后生成的白色物质进行了如下探究:
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
思考与交流:
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
实验:将燃烧的钠迅速伸入到盛满二氧化碳的集气瓶中,钠在其中继续燃烧至完全,反应后冷却,瓶底附着黑色颗粒,瓶壁上附着白色物质.
查资料:Na2O+H2O=2NaOH
提出假设:燃烧后瓶璧上附着的白色物质是什么?
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3
假设3:白色物质可能是Na2O和Na2CO3的混合物.
设计实验方案,验证假设
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
(1)甲同学认为方案1得到的结论不正确,其理由是Na2CO3的水溶液显碱性,遇酚酞变红色
(2)根据方案2的结论,补齐方案2中②的实验操作,并写出相应的实验现象.
实验操作:滴加酚酞试液 实验现象:溶液颜色没有变化(上层清液是NaCl显中性)
(3)乙同学认为白色物质可能是NaOH,你填不同意(同意或不同意)该同学的观点,并简述理由:反应物中无氢元素,违背质量守恒定律
(4)根据假设2,写出钠在二氧化碳中燃烧的化学方程式:4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$2Na2CO3+C.
14.下列各组离子在强碱性溶液里能大量共存的是( )
| A. | Na+、K+、Mg2+、SO42- | B. | Ba2+、Na+、NO3-、HCO3- | ||
| C. | Na+、K+、S2-、CO32- | D. | Na+、S2- ClO-、Cl- |
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
18.由短周期元素构成的某离子化合物X中,一个阳离子和一个阴离子核外电子数之和为20,则有关X的下列说法中正确的是( )
| A. | X中阳离子和阴离子个数一定相等 | |
| B. | X中可能既含离子键,又含共价键 | |
| C. | 若X只含两种元素,则两种元素可在同一周期也可在同一主族 | |
| D. | X中阳离子半径一定大于阴离子半径 |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
12.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
13.下列叙述正确的是( )
| A. | 烷烃分子中,碳原子都以碳碳单键结合,其余的价键均与氢原子结合,这一系列化合物的分子通式为C2nH2n+2 | |
| B. | 分子组成相差一个或若干个CH2原子团的物质,互称为同系物 | |
| C. | 烷烃分子中,相邻的三个碳原子有可能在同一条直线上 | |
| D. | 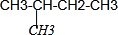 CH4、CH3CH2CH3互为同系物 CH4、CH3CH2CH3互为同系物 |