题目内容
20.下列电子是正确的是( )| A. | 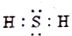 | B. | 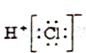 | C. | 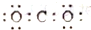 | D. | 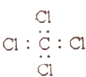 |
分析 A、硫化氢为共价化合物,S分别与H形成1对共价键;
B、HCl为共价化合物,Cl与H形成1对共价键;
C、二氧化碳中C分别与O形成2对共价键;
D、四氯化碳中Cl原子最外层电子数达到了8个电子的稳定结构,据此解答即可.
解答 解:A、硫化氢为共价化合物,S分别与H形成1对共价键,电子式为: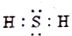 ,故A正确;
,故A正确;
B、HCl分子是由1个氢原子和1个氯原子通过共用1对电子结合而成的共价化合物其电子式为 ,故B错误;
,故B错误;
C、CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D、四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故D错误,故选A.
,故D错误,故选A.
点评 本题主要考查了电子式的书写,题目难度不大,注意掌握电子式的概念及表示方法,明确离子化合物与共价化合物的电子式的表示方法.

练习册系列答案
相关题目
10.若某基态原子的外围电子排布为4d15s2,则下列说法错误的是( )
| A. | 该元素位于第5周期,ⅢB族 | B. | 该元素原子核外有5个电子层 | ||
| C. | 该元素原子最外层共有2个电子 | D. | 该元素原子M能层共有8个电子 |
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )
| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
8.下列过程中,不可逆的是( )
| A. | 蛋白质的盐析 | B. | 乙酸的电离 | ||
| C. | 酯在酸的催化下的水解 | D. | 蛋白质的变性 |
5.下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
| A. | H+、NO3-、Fe2+、Cu2+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Na +、HCO3-、SO42- | D. | Na+、NH4+、Br-、OH- |
12.下列各组微粒具有相同的质子数和电子数的是( )
| A. | OH-、H2O、F- | B. | H3O+、NH4+、Cl- | C. | HF、Ne、H2O | D. | NH3、NH4+、F- |
9.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到下图,则曲线a、b、c、d所对应的实验组别可能是( )
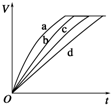
| 组别 | c(HCl)(mol•L-1) | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 50 | 粉末状 |

| A. | 1-2-4-3 | B. | 1-2-3-4 | C. | 3-4-2-1 | D. | 4-3-2-1 |