题目内容
11.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的( )| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
分析 A元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;B元素原子次外层是最外层电子数的2倍,若有2个电子层,最外层电子数为1,则B为Li,若有3个电子层,最外层电子数为4,则B为Si,据此解答.
解答 解:A元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;B元素原子次外层是最外层电子数的2倍,若有2个电子层,最外层电子数为1,则B为Li,若有3个电子层,最外层电子数为4,则B为Si.
A.A为O元素,处于第二周期,若B为Si时,处于第三周期,故A错误;
B.A为ⅥA族元素,B为IA族或ⅣA族元素,故B错误;
C.B为Li或Si,处于第二周期IA族或第三周期ⅥA族,故C错误;
D.A和B可以相互化合形成化合物Li2O或SiO2,故D正确,
故选D.
点评 本题考查原子结构与位置关系,注意根据核外电子排布判断元素,侧重对基础知识的巩固.

练习册系列答案
相关题目
6.已知:4A(g)+5B(g)=4C(g)+6D(g),如果反应速率分别用v(A)、v(B)、v(C)、v(D)表示,正确的关系是( )
| A. | $\frac{4}{5}$v(A)=V(B) | B. | $\frac{5}{6}$v(B)=v(D) | C. | $\frac{2}{3}$v(A)=V(D) | D. | $\frac{4}{5}$v(B)=v(C) |
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
20.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. |  和 和 是同一种物质 是同一种物质 |
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )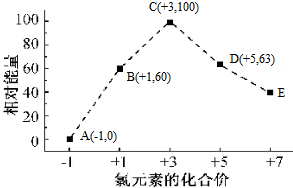

| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
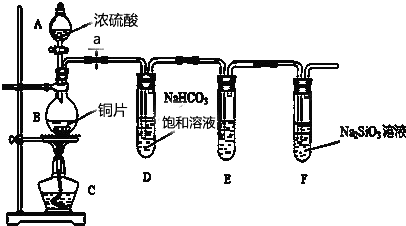


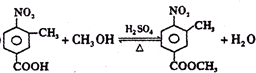 ,使用过量CH3OH的作用是提高D的产率.
,使用过量CH3OH的作用是提高D的产率.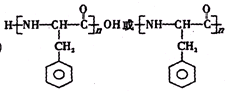 .
.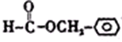 .
.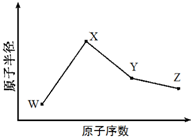 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.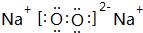 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式). .
.