题目内容
1.某化学兴趣小组进行实验探究:探究碳、硅元素的非金属性的相对强弱.实验装置如下,请根据要求回答下列问题: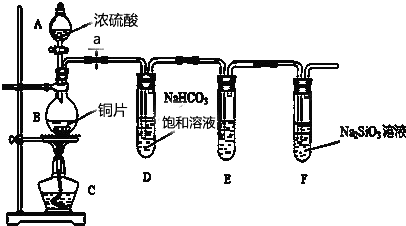
(1)填写所示仪器名称A分液漏斗
(2)实验步骤:连接仪器、检验装置气密性、加药品后,打开a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.装置E中盛足量酸性KMnO4溶液的作用是除去二氧化硫气体
②该实验证明碳元素的非金属性比硅元素非金属性强的实验依据是强酸制取弱酸.请写出F 中发生反应的离子方程式CO2+SiO32-+H2O=H2SiO3↓+CO32-
③依据试管D中的发生的反应,能否证明硫元素的非金属性强于碳元素的非金属性否(填“能”或“否”),原因是亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物).
分析 (1)A名称是分液漏斗;
(2)连接好仪器后,要检验装置气密性,然后装药品;
(3)①铜和浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱.
解答 解:(1)A名称是分液漏斗,故答案为:分液漏斗;
(2)连接好仪器后,要检验装置气密性,然后装药品,否则易导致实验失败,故答案为:检验装置气密性;
(3)①铜和浓硫酸在加热条件下发生反应生成硫酸铜、二氧化硫和水,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液除去二氧化硫气体,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;除去二氧化硫气体;
②元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,所以可以根据强酸制取弱酸判断非金属性强弱,其离子方程式为CO2+SiO32-+H2O=H2SiO3↓+CO32-,
故答案为:强酸制取弱酸;CO2+SiO32-+H2O=H2SiO3↓+CO32-;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强,不能根据其非最高价氧化物的水化物酸性强弱判断非金属性强弱,亚硫酸不是S元素的最高价氧化物的水化物,所以不能据此判断非金属性强弱,
故答案为:否;亚硫酸不是硫元素的最高价氧化物的水化物(或SO2不是S的最高价氧化物).
点评 本题以浓硫酸和铜反应为载体考查性质实验方案设计,明确实验原理及物质性质是解本题关键,知道操作步骤、实验目的及物质性质即可解答,注意不能根据亚硫酸的酸性强弱判断S元素非金属性强弱,为易错点.

| A. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA | |
| B. | 0.1molCmH2n+2中含有的碳碳单键数为0.1nNA | |
| C. | 2.8g乙烯和丙烯的混合气体中所含碳原子为0.2NA | |
| D. | 1mol苯乙烯中含有的碳碳双键数为4NA |
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | 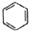 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$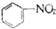 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$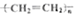 |
| A. | 4种 | B. | 5种 | C. | 7种 | D. | 8种 |
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.
某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.