题目内容
19.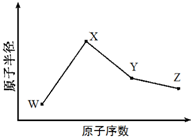 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.(1)X位于元素周期表中第三周期第IA族;W的这种核素的原子组成符号为188O.
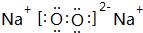
(2)X与W形成的原子个数比为1:1的化合物的电子式为
 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).(3)用电子式表示化合物XZ的形成过程:
 .
.
分析 W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为18,中子数为10,则其质子数为18-10=8,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的单质是一种常见的半导体材料,原子序数大于Na,故Y为Si;Z的原子半径在同周期主族元素中最小,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素.
(1)X为Na元素,位于元素周期表中第三周期第IA族;W的这种核素的原子组成符号为:188O,
故答案为:三、IA;188O;
(2)X与W形成的原子个数比为1:1的化合物Na2O2,其电子式为 ,由于非金属性Cl>Br,故氢化物稳定性HCl>HBr,
,由于非金属性Cl>Br,故氢化物稳定性HCl>HBr,
故答案为: ;HCl;
;HCl;
(3)化合物XZ为NaCl,用电子式表示形成过程为: ,
,
故答案为: .
.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,侧重对化学用语的考查,有利于学生对基础知识的巩固,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
9.下列有机反应的方程式书写错误的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. |  +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$ +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$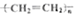 |
7.下列有关图象说法正确的是( )
| A. | 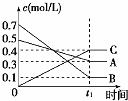 表示反应的方程式为5A(g)+7B(g)?4C(g) | |
| B. | 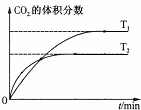 表示反应5CO(g)+I2O5(s)?5CO2(g)+I2(s)△H<0 | |
| C. | 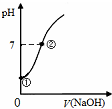 表示向饱和氯水中逐滴滴入0.1mol•L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 | |
| D. | 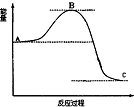 表示4H2(g)+2NO2(g)=N2(g)+4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
14.2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料为65%丁烷(C4H10)和35%丙烷,下列有关说法正确的是( )
| A. | 符合通式CnH2n+2的均属于烷烃 | B. | 丙烷分子中所有原子共平面 | ||
| C. | 丁烷的一氯代物有5种 | D. | 以上说法均不正确 |
4.下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
| A. | CH3-CHCl-CH2-CH3 | B. | 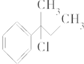 | ||
| C. | CH3-C(CH3)Cl-CH2-CH3 | D. | 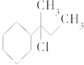 |
11.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的( )
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
8.下列关于化学键的说法正确的是( )
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 非极性键只存在于双原子分子中 | |
| C. | 构成单质分子的微粒一定含有共价键 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
9.向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+3OH-?Cr(OH)3(灰蓝色)?CrO2-(绿色)+H++H2O.将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液.a、b试管中溶液颜色最终分别为( )
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |