题目内容
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )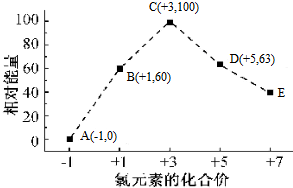
| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
分析 A、物质具有的能量越高越不稳定,根据图示信息来回答;
B、根据图物质具有的能量越高越不稳定,根据图示信息来回答
C、图示曲线可知Cl元素的化合价越来越高,由曲线可知D中Cl元素的化合价是+7价,因此ClOx-中x=4,即D为ClO3-,A为Cl-、B为ClO-,B→A+D的化学方程式为3ClO-=2Cl-+ClO3-,结合曲线可知ClO-相对Cl-的能量为60 kJ,ClO3-相对Cl-的能量为63 kJ,据此计算该反应的反应热;
D、根据歧化反应的规律和特点来回答判断.
解答 解:A、根据图示信息,氯元素的化合价越高,物质具有的能量先是升高后是降低,故A错误;
B、根据图示信息,氯元素的化合价越高,物质具有的能量先是升高后是降低,稳定性显示降低后是增强,故B错误;
C、图示曲线可知Cl元素的化合价越来越高,由曲线可知D中Cl元素的化合价是+7价,因此ClOx-中x=4,即D为ClO3-,A为Cl-、B为ClO-,B→A+D的化学方程式为3ClO-=2Cl-+ClO3-,结合曲线可知ClO-相对Cl-的能量为60 kJ,ClO3-相对Cl-的能量为63 kJ,因此该反应的反应热为△H=(63-60)kJ•mol-1-2×60 kJ•mol-1=-117 kJ•mol-1,故C正确;
D、ClO2-→ClO3-+ClO4-中氯元素的化合价从+3升高到了+5价和+7价,化合价只升高了,没有降低,所以以自发进行不能自发进行,故D错误.
故选C.
点评 本题是一道信息给定题,解体的关键是明确元素的化合价和微粒的能量之间的关系,难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
11.A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层是最外层电子数的2倍,则关于A、B元素的判断正确的( )
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
12.某元素原子M层电子数是K层电子数的3.5倍,则该元素最高价氧化物对应水化物的化学式为( )
| A. | HClO4 | B. | HNO3 | C. | H2SO4 | D. | H3PO4 |
9.向紫色Cr2(SO4)3溶液中加入NaOH溶液至析出蓝灰色沉淀,此时,溶液中存在着如下平衡:Cr3+(紫色)+3OH-?Cr(OH)3(灰蓝色)?CrO2-(绿色)+H++H2O.将上述悬浊液等分为两份,向a试管中加入适量的NaOH溶液,向b试管中加入适量的H2SO4溶液.a、b试管中溶液颜色最终分别为( )
| 选项 | A | B | C | D |
| a试管 | 紫色 | 蓝灰色 | 绿色 | 蓝灰色 |
| b试管 | 绿色 | 绿色 | 紫色 | 紫色 |
| A. | A | B. | B | C. | C | D. | D |
16.以下变化过程中化学键肯定没有破坏的是( )
| A. | 水蒸气与铁粉共热 | B. | 熔融氯化镁 | ||
| C. | 乙醇溶于水 | D. | 粉碎金刚石 |
6.下列分子中所有原子都满足最外层为8电子结构的是( )
| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |
10.下列叙述中正确的是( )
| A. | NH3、CO、CO2都是极性分子 | |
| B. | BF3、SiCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、Hl的稳定性依次增强 | |
| D. | CS2、H2O、C2H2都是直线型分子 |
11.下列有关说法正确的是( )
| A. | 反应2NO2═N2O4在室温下可自发进行,则该反应的△H<0 | |
| B. | 工业上电解熔融态氯化铝冶炼单质铝 | |
| C. | CH3COOH 溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH 减小 |