题目内容
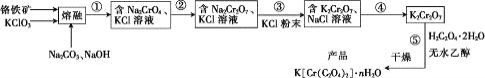
【题目】以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如下:
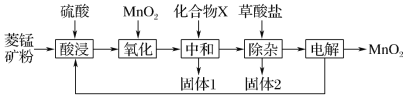
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:__________________________________________。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用______________________(写一种物质的化学式)。
(3)该工艺流程中固体1和固体2均需用水洗涤,目的是______________________。
(4)“除杂”时,除去的金属离子有______________________________________。
(5) 该流程中可以循环使用的物质有________。
(6)电解过程中MnO2 在______(填“阴”或“阳”)极生成。
【答案】MnO2+2Fe2++4H+=Mn2+ +2Fe3++2H2O CaCO3(或MnCO3等合理答案均可) 用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率(或用水洗涤滤渣,洗出液循环利用,提高锰的回收率等合理答案均可) Ca2+、Mg2+ H2SO4、MnO2 阳
【解析】
菱锰矿粉加入硫酸酸浸,得到亚铁离子、铁离子、钙离子、铝离子、镁离子的溶液,加入二氧化锰,将亚铁离子氧化成铁离子,加入化合物X中和硫酸,“中和”的目的是将铁、铝元素转化为沉淀除去,为了不引入新的杂质,结合实验目的,X可以为碳酸锰等;得到氢氧化铁和氢氧化铝的沉淀,加入草酸盐,得到草酸钙和草酸镁的沉淀和硫酸锰的溶液,通过电解硫酸锰溶液,最终得到产品二氧化锰和硫酸,据此分析解答。
(1)酸浸后,溶液中含有亚铁离子,亚铁离子能被二氧化锰氧化,得到三价铁离子和二价锰离子,故反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)中和的目的是将铁离子与铝离子转化成沉淀,过滤除去,在此过程中,要除去杂质又不能引入新的杂质,阳离子为锰离子、钙离子、镁离子,故化合物X可以为MnCO3或CaCO3等,故答案为:MnCO3或CaCO3等;
(3)过滤得到的沉淀表面含有滤液中的离子,因此,在流程中要用水洗涤滤渣,洗出液可用于回收,或利用在酸浸操作,加大物质的利用率,提高锰的回收率,故答案为:用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率;
(4)已知草酸钙、草酸镁不溶于水,则除杂时除去的就是Ca2+和Mg2+,故答案为:Ca2+和Mg2+;
(5)硫酸锰电解生成二氧化锰和硫酸,酸浸操作要用到硫酸,氧化过程用到二氧化锰,故该流程中可以循环使用的物质有H2SO4、MnO2,故答案为:H2SO4、MnO2;
(6)根据电解原理,阳极发生氧化反应,阴极发生还原反应,锰离子失去电子转化为二氧化锰,发生氧化反应,应该在阳极上发生,故答案为:阳。

【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4