题目内容
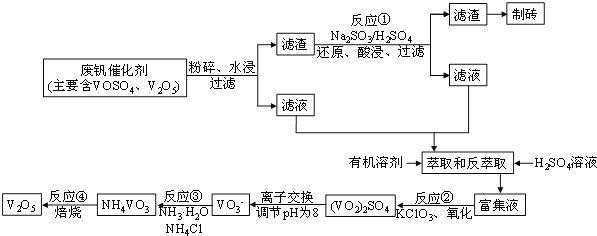
【题目】关于下列各实验装置的叙述中,不正确的是
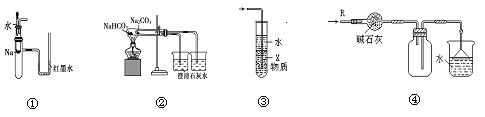
A.装置①可用于验证Na与H2O反应是否放热
B.装置②可用于比较Na2CO3与NaHCO3的稳定性
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
【答案】B
【解析】
A.若Na与水反应放热,则则会使具支试管内的空气体积膨胀,是U型管内左侧液面下降,右侧液面上升,因此装置①可用于验证Na与H2O反应是否放热,A正确;
B.若要证明二者的稳定性的大小,应该把NaHCO3放在外管,把Na2CO3放在内管,所以装置②不可用于比较Na2CO3与NaHCO3的稳定性,B错误;
C.由于HCl和NH3极容易溶于水,若直接通入水中,会由于气体在水中溶解,会导致导气管内的气体压强减小,从而引发倒吸现象,若直接通入CCl4,则NH3或HCl不能在该试剂溶解,气体上升,溶解在水中,同时也防止了倒吸现象的发生,因此装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸,C正确;
D.氨气密度比空气小,与碱不能发生反应,由于非常容易溶于水,所以在水面上导管末端安装应该倒扣的漏斗来防止倒吸现象的发生,故装置④可用于干燥、收集NH3,并吸收多余的NH3,D正确;
故选B。

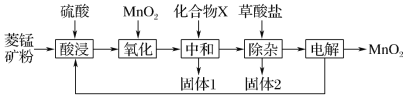
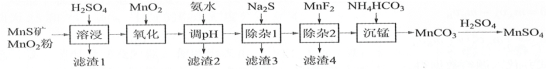
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。