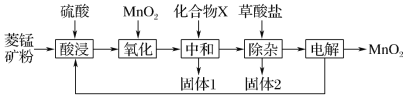
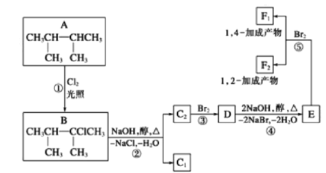
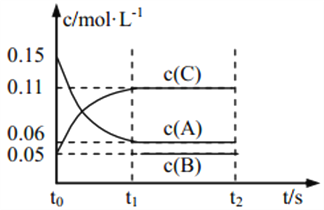
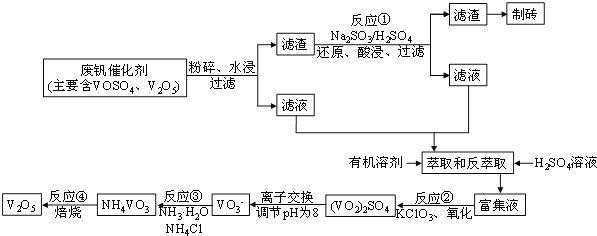
题目内容
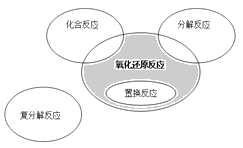
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4NH3+5O2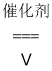 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2↑
【答案】C
【解析】
化学反应根据反应物和生成物的种类,把化学反应分成四种基本反应类型,化合反应,分解反应,置换反应,复分解反应。根据化学反应中是否有化合价的变化分成氧化还原反应和非氧化还原反应;图中的阴影部分表示不属于化合反应,分解反应,置换反应的氧化还原反应。
A. 该反应是氧化还原反应,也是化合反应,不属于阴影部分,故A 错误;
B. 反应不是氧化还原反应,也是分解反应,不属于阴影部分,故B 错误;
C. 反应是氧化还原反应,不是置换反应,不是化合反应,也不是分解反应,属于阴影部分,故 C正确;
D. 该反应是氧化还原反应,但又是置换反应,不属于阴影部分,故 D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】在20 L的密闭容器中按物质的量之比为1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强下的变化如图所示,p2和195 ℃时n(H2)随时间的变化结果如表所示。下列说法正确的是( )
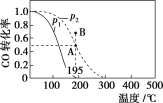
p2及195 ℃ 时n(H2)随时间变化
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 5 | 4 | 4 |
A. p1>p2,ΔH<0
B. 在p2及195 ℃ 时,反应前3 min的平均速率v(CH3OH)=0.8 mol·L-1·min-1
C. 在p2及195 ℃ 时,该反应的平衡常数为25
D. 在B 点时,v正>v逆